题目内容
实验室欲制取22克二氧化碳,需要多少克质量分数为14.6%的盐酸?反应中消耗的碳酸钙为多少克?反应后所得溶液的质量为多少克?
【答案】分析:写出化学方程式并把数据代入计算即可.
解答:解:设需要氯化氢的质量是X克,需要碳酸钙的质量是Y克.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
Y X 22
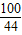 ═
═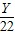
∴Y=50
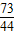 ═
═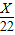
∴X=36.5
∴质量分数为14.6%的盐酸的质量是36.5÷14.6%═250克.
∴反应后溶液的质量是50+250-22=278克.
答:实验室欲制取22克二氧化碳,需要250克质量分数为14.6%的盐酸,反应中消耗的碳酸钙为50克,反应后所得溶液的质量为278克.
点评:掌握化学方程式计算的格式,解和答都不要省略.
解答:解:设需要氯化氢的质量是X克,需要碳酸钙的质量是Y克.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
Y X 22
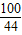 ═
═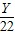
∴Y=50
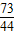 ═
═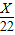
∴X=36.5
∴质量分数为14.6%的盐酸的质量是36.5÷14.6%═250克.
∴反应后溶液的质量是50+250-22=278克.
答:实验室欲制取22克二氧化碳,需要250克质量分数为14.6%的盐酸,反应中消耗的碳酸钙为50克,反应后所得溶液的质量为278克.
点评:掌握化学方程式计算的格式,解和答都不要省略.

练习册系列答案
相关题目