题目内容
 (1)20℃时,甲物质的溶解度为______g;
(1)20℃时,甲物质的溶解度为______g;
(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采 用的方法是______;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量______(选填“>”或“=”或“<”)乙物质溶液的质量.
(4)下表为KCl在不同温度下的溶解度:
| 温度╱℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度╱g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
①由上表可推测KCl溶解度随温度的升高而______(填“增大”或“减小”).
②在10℃时,向100g水中加入40g KCl固体,充分混合溶解后所得溶液为______(填“饱和”或“不饱和”)溶液,此过程中的玻璃棒的作用为______;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为______(计算结果精确到0.1%).
解:(1)20℃时,甲物质的溶解度为40g;
(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是加水或降温;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,由甲物质析出,故所得甲物质溶液的质量<乙物质溶液的质量.
(4)由表中KCl在不同温度下的溶解度可知:
| 温度╱℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度╱g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
①由上表可推测KCl溶解度随温度的升高而增大.
②在10℃时,因为其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液为饱和溶液;此过程中的玻璃棒的作用为加快溶解速率;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为 ×100%=28.6%.
×100%=28.6%.
故答为:
(1)40;
(2)加水或降温;
(3)<;
(4)①增大 ②饱和 加快溶解速率 28.6%
分析:由题目中的甲、乙两种物质的溶解度曲线图可知:
(1)20℃时,甲物质的溶解度;
(2)由图可知,乙物质的溶解度随温度增加而降低,故可知欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,考虑甲物质和乙物质的溶解度变化情况.
(4)由表中KCl在不同温度下的溶解度可知:
①由上表可推测KCl溶解度随温度变化情况.
②由表中溶解度可知,在10℃时,其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液种类;掌握溶解过程中的玻璃棒的作用;将其温度升高到50℃时,若不考虑溶剂的变化,则可计算该溶液中溶质的质量分数.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.

 星级口算天天练系列答案
星级口算天天练系列答案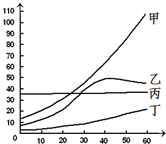 结合表列出几种物质在不同温度时的溶解度回答以下问题.
结合表列出几种物质在不同温度时的溶解度回答以下问题.| 温度/℃ | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
| 溶解度/g | 高锰酸钾 | 2.8 | 4.3 | 6.4 | 9.0 | 12.6 | 18.0 | 22.1 |
| 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.5 | 49.0 | 48.0 | 45.0 | |
| 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
| 硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
(2)表中氯化钠和硝酸钾具有相同溶解度的温度范围是
(3)从溶液中得到晶体主要有以下两种方法.若从硝酸钾的饱和溶液中得到晶体,最常用的方法为
A.蒸发溶剂 B.冷却热的饱和溶液
(4)在通常状况下,下列四种物质中属于易溶物的是
A.高锰酸钾 B.碳酸钠
C.氯化钠 D.硝酸钾
(5)如图所示溶解度曲线中,表示碳酸钠溶解度随温度变化的曲线为
A.甲 B.乙 C.丙 D.丁
(6)60℃时,配制等质量的上述四种溶质的饱和溶液,需要溶质质量最少的是
A.高锰酸钾 B.碳酸钠
C.氯化钠 D.硝酸钾.
下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度/g |
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
|
NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(填A或B)。

(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发
水后再恢复到原温度,⑥加入生石灰。其中措施正确的是 。
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶
液中溶质的质量分数 乙 甲(填“>”、“<”或“=”)。
现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物 理方法是 。
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH
(填“偏大”、“偏小”或“不受影响”)。



