题目内容
如图是利用锌粒与盐酸反应制取纯净氢气,并用以测定水的组成的实验装置.

(1)装置B的作用是 ;有关化学方程式为 .
(2)装置D中的现象是 化学方程式为 .
(3)装置E中放有无水CaCl2,用来吸收生成的水,若反应后D的质量减少1.32g,E的质量增加1.485g,试通过计算求出水中氢、氧两种元素的质量比(最简整数比).

(1)装置B的作用是
(2)装置D中的现象是
(3)装置E中放有无水CaCl2,用来吸收生成的水,若反应后D的质量减少1.32g,E的质量增加1.485g,试通过计算求出水中氢、氧两种元素的质量比(最简整数比).
考点:氢气的制取和检验,气体的净化(除杂),书写化学方程式、文字表达式、电离方程式,氢气的化学性质与燃烧实验
专题:综合实验题
分析:(1)根据氢氧化钠能与氯化氢气体反应分析装置B的作用,写出反应的有关方程式;
(2)根据氢气和氧化铜的反应分析反应的现象,写出反应的方程式.
(3)由于氢气和氧化铜的反应生成了铜和水,根据质量守恒定律可知,D装置减轻的质量就是氧化铜中氧元素,也就是生成的水中氧元素的质量,根据题中的数据即可计算水中氢、氧两种元素的质量比.
(2)根据氢气和氧化铜的反应分析反应的现象,写出反应的方程式.
(3)由于氢气和氧化铜的反应生成了铜和水,根据质量守恒定律可知,D装置减轻的质量就是氧化铜中氧元素,也就是生成的水中氧元素的质量,根据题中的数据即可计算水中氢、氧两种元素的质量比.
解答:解:(1)由于盐酸易挥发出氯化氢气体,氢氧化钠能与氯化氢气体反应.所以,装置B的作用是除去氯化氢气体,反应的有关方程式是:NaOH+HCl═NaCl+H2O;
(2)在加热的条件下,氢气能还原氧化铜生成了铜和水,所以,装置D中的现象是:黑色粉末变成红色,化学方程式为:CuO+H2
Cu+H2O.
(3)根据题中的装置和反应可知,由于氢气和氧化铜的反应生成了铜和水,根据质量守恒定律可知,D装置减轻的质量就是氧化铜中氧元素的质量,也就是生成的水中氧元素的质量,是1.32g;E的质量增加1.485g就是生成的水的质量是1.485g.所以,水中氢、氧两种元素的质量比是:(1.485g-1.32g):1.32g=0.165g:1.32g=1:8.
故答为:(1)除去氯化氢气体; NaOH+HCl═NaCl+H2O;(2)黑色粉末变成红色,CuO+H2
Cu+H2O;
(3)水中氢、氧两种元素的质量比是1:8.
(2)在加热的条件下,氢气能还原氧化铜生成了铜和水,所以,装置D中的现象是:黑色粉末变成红色,化学方程式为:CuO+H2
| ||
(3)根据题中的装置和反应可知,由于氢气和氧化铜的反应生成了铜和水,根据质量守恒定律可知,D装置减轻的质量就是氧化铜中氧元素的质量,也就是生成的水中氧元素的质量,是1.32g;E的质量增加1.485g就是生成的水的质量是1.485g.所以,水中氢、氧两种元素的质量比是:(1.485g-1.32g):1.32g=0.165g:1.32g=1:8.
故答为:(1)除去氯化氢气体; NaOH+HCl═NaCl+H2O;(2)黑色粉末变成红色,CuO+H2
| ||
(3)水中氢、氧两种元素的质量比是1:8.
点评:典型的实验探究题,熟练掌握氢气还原氧化铜的性质和实验才能准确解答该题,要分析清楚每步实验的目的即可准确解答该题.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
下列属于溶液且溶质是化合物的是( )
| A、稀硫酸 | B、碘酒 |
| C、液态氧气 | D、澄清石灰水 |

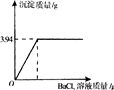 实验室里有一瓶固体烧碱因吸收了空气中的二氧化碳而部分变质.为测定这瓶烧碱的纯度,称取该样品20g,溶于水配成溶液,向其中逐滴加入氯化钡溶液至沉淀完全,反应过程中生成沉淀的质量与所用氯化钡溶液质量关系如图所示.
实验室里有一瓶固体烧碱因吸收了空气中的二氧化碳而部分变质.为测定这瓶烧碱的纯度,称取该样品20g,溶于水配成溶液,向其中逐滴加入氯化钡溶液至沉淀完全,反应过程中生成沉淀的质量与所用氯化钡溶液质量关系如图所示.

 金属用途广泛,其结构和性质等是化学的重要研究内容.
金属用途广泛,其结构和性质等是化学的重要研究内容.