题目内容
14.实验室用加热9g高锰酸钾的方法制取氧气,剩余固体为8.2g,通过计算决定8.2g固体中含有的物质有哪些?他们的质量各是多少?分析 高锰酸钾受热分解后生成锰酸钾、二氧化锰和氧气,由于氧气逸出,所以反应后固体质量会减少;根据质量守恒定律可知,固体质量的减少量即为生成氧气的质量,然后根据反应方程式由氧气的质量求出参加反应的高锰酸钾的质量.
解答 解:(1)由质量守恒定律可知生成氧气的质量为:9g-8.2gg=0.8g;
(2)设参加反应的KMnO4质量为x,反应生成的K2MnO4质量为y、MnO2质量分别为z.
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4 +MnO2 +O2↑
316 197 87 32
x y z 0.8g
$\frac{316}{x}$=$\frac{197}{y}$=$\frac{87}{z}$=$\frac{32}{0.8g}$
解得:x=7.9g y=4.925g z=2.175g
所以可以判断高锰酸钾没有完全反应,所以剩余的固体中含有的物质为:高锰酸钾、锰酸钾、二氧化锰,其中剩余的高锰酸钾的质量为:9g-7.9g=1.1g
答:8.2g固体中含有的物质有高锰酸钾、锰酸钾和二氧化锰,其中高锰酸钾的质量为1.1g,锰酸钾的质量为4.925g,二氧化锰的质量为2.175g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
5.下列情况一定会发生化学变化的是( )
| A. | 产生气体 | |
| B. | 两种物质混合 | |
| C. | 分子被破坏,原子重新组合成新的分子 | |
| D. | 一种物质的分子进入到另一种物质的分子中间 |
2.食品添加剂溴酸钾(KBrO3)会致癌,已被禁用,其中溴元素(Br)的化合价为( )
| A. | +1 | B. | +3 | C. | +5 | D. | -3 |
19.以下关于化学实验中“先与后”的说法中正确的是( )
| A. | 实验室制取气体时,先装药品后检查装置气密性 | |
| B. | 做一氧化碳与氧化铁反应实验时,先加热氧化铁后通一氧化碳 | |
| C. | 做一氧化碳与氧化铁反应实验时,反应完毕后,先停止加热待玻璃管冷却后停止通一氧化碳 | |
| D. | 给试管中固体加热时,先集中对准固体加热后均匀加热 |
6.在学习“石灰石和钟乳石”时,小明和老师做了如图1所示的一组对比实验.

根据上述实验回答下列问题:
(1)小明的实验现象说明石灰石灼烧时没有反生化学反应,其本质原因是加热的温度不够,碳酸钙没有分解;
(2)老师的实验中酚酞溶液变红,说明溶液呈碱性,用化学方程式表示其原因CaO+H2O=Ca(OH)2
(3)若老师实验时夹持的石灰石质量为10克,灼烧完全后剩余固体为5.6克(所含杂质在灼烧过程中不发生变化),请回答下列问题:
①当石灰石完全反应后,生成CO2的物质的量为0.1mol;
②求该石灰石中CaCO3的物质的量(根据化学方程式列式计算)0.1mol.

| 实验操作 | 实验现象 | |
| 小明 | 用坩埚钳夹持一小块石灰石,在酒精灯的火焰上灼烧(如图1所示),2分钟后,把它投入含有酚酞的蒸馏水中 | 酚酞溶液不变色 |
| 老师 | 用坩埚钳夹持一小块石灰石,在酒精喷灯火焰上灼烧(如图2所示),2分钟后,把它投入含有酚酞的蒸馏水中 | 酚酞溶液变红 |
(1)小明的实验现象说明石灰石灼烧时没有反生化学反应,其本质原因是加热的温度不够,碳酸钙没有分解;
(2)老师的实验中酚酞溶液变红,说明溶液呈碱性,用化学方程式表示其原因CaO+H2O=Ca(OH)2
(3)若老师实验时夹持的石灰石质量为10克,灼烧完全后剩余固体为5.6克(所含杂质在灼烧过程中不发生变化),请回答下列问题:
①当石灰石完全反应后,生成CO2的物质的量为0.1mol;
②求该石灰石中CaCO3的物质的量(根据化学方程式列式计算)0.1mol.
4.科学实验必须按规范进行操作,下列实验操作中规范的是( )
| A. |  取少量氯化钠 | B. |  闻药品气味 | C. |  滴加液体 | D. |  取金属锌粒 |
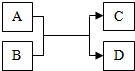 A、B、C、D都是初中化学中常见物质,它们间关系如图所示(反应条件已省略).(1)若A为一氧化碳,C为金属,则D为CO2;
A、B、C、D都是初中化学中常见物质,它们间关系如图所示(反应条件已省略).(1)若A为一氧化碳,C为金属,则D为CO2;