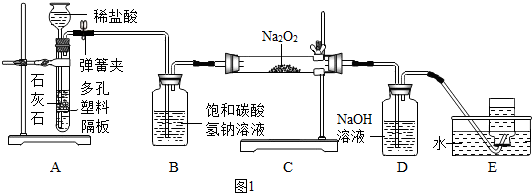
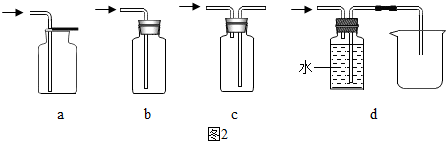
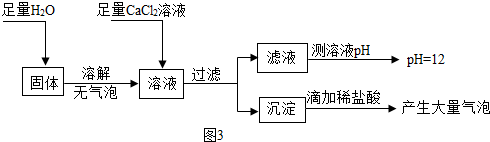
题目内容
14.人类第一次获得金属铝是在1825年,由丹麦化学家用无水AlCl3与钾作用制得的.当时由于价格非常昂贵,称为“银色的金子”.直到19世纪后期发明了电解法制铝,才使铝的价格大大下降,使铝成为当今广泛应用的一种金属材料.铝的熔点660℃,氧化铝的熔点2050℃.铝常温下既能与酸反应,还能与强碱(如NaOH)反应,是一种两性金属.铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝定为“食品污染源之一”而加以控制.(1)下列关于铝的叙述,不正确的是BCDE(填序号)
A.铝是地壳中含量最多的金属元素
B.铝只能与酸反应,不能与碱反应
C.铝是人类最早生产和使用的金属
D.铝保存时间较长,是因为铝的化学性质不活泼
E.禁止用铝作导线
(2)某同学用坩埚钳夹住一块铝箔在酒精灯上加热至熔化,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜者,原因是铝表面有一层致密的氧化铝薄膜,氧化铝的熔点高
再取一块铝箔,用砂纸仔细打磨,再加热至熔化,发现熔化的铝仍不滴落,用化学方程式说明原因4Al+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3
(3)胃酸过多会使身体不适形成疾病,常用胃舒平来治疗,胃舒平主要成分为Al(OH)3,试写出服用胃舒平后,胃中发生的反应方程式:Al(OH)3+3HCl═AlCl3+3H2O
目前这种胃药已不常用,原因主要是铝在人体内积累可使人慢性中毒
(4)工程技术人员用铝粉和氧化铁粉末在高温下反应,产生铁和氧化铝,反应放出大量的热,生成的铁水填充短轨之间的缝隙,从而将短轨连接成长轨,该反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应属于置换反应(填反应基本类型).
分析 (1)根据铝的性质及题目信息进行逐项判断;
(2)根据铝的熔点及氧化铝的熔点进行比较解释;
(3)根据氢氧化铝和盐酸发生中和反应写出反应的方程式;根据信息铝在人体内积累可使人慢性中毒解释原因;
(4)根据信息铝粉和氧化铁粉末在高温条件下反应后,除生成铁水外,还能生成氧化铝;根据反应的特点分析反应类型.
解答 解:(1)A.铝是地壳中含量最多的金属元素的说法正确;
B.根据题目信息铝常温下既能与酸反应,还能与强碱(如NaOH)反应,是一种两性金属,因此铝只能与酸反应,不能与碱反应的说法错误;
C.根据信息铝是人类生产和使用较晚的金属,故说法错误;
D.铝保存时间较长,是因为铝表面有一层致密的氧化铝,故说法错误;
E.铝具有导电性,可以作导线,故说法错误;
故答案为:(1)BCDE;
(2)铝的熔点660℃,氧化铝的熔点2050℃,而铝容易和氧气反应表面产生致密的氧化铝,因此加热时铝熔化而氧化铝没有熔化,因此会发现熔化的铝不滴落,好像有一层膜兜者;再取一块铝箔,用砂纸仔细打磨,再加热至熔化,加热过程中铝和氧气反应产生氧化铝薄膜,因此仍然发现熔化的铝不滴落,反应的方程式为:4Al+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3;
故答案为:铝表面有一层致密的氧化铝薄膜,氧化铝的熔点高; 4Al+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3;
(3)氢氧化铝和盐酸反应产生氯化铝和水,该反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O;铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝定为“食品污染源之一”而加以控制,因此胃舒平不再常用;
故答案为:Al(OH)3+3HCl═AlCl3+3H2O; 铝在人体内积累可使人慢性中毒;
(4)铝粉和氧化铁粉末在高温条件下反应后,除生成铁水外,还能生成氧化铝.,因此反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,因此属于置换反应.
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;置换.
点评 本题考查了有关铝及其化合物的性质,并利用题目信息进行解决相关的问题,考查了学生的知识运用能力及综合知识能力.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | NaCl溶液(Na2CO3) | Ca(OH)2溶液 | 过滤 |
| B | KNO3(NaCl) | H2O | 蒸发、过滤 |
| C | N2(O2) | 足量铜粉 | 加热 |
| D | 稀硫酸(稀盐酸) | 适量氯化钡溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 选择自行车和公交车作为出行工具 | |
| B. | 将废纸、汽水瓶等收集起来,一次性焚烧 | |
| C. | 让衣服自然晾干,节约用纸,不使用一次性塑料袋 | |
| D. | 拒绝使用一次性木筷,用电子贺卡代替纸质贺卡 |
| A. | 电器着火--用水泼灭 | B. | 熄灭酒精灯--用嘴吹灭 | ||
| C. | 图书档案着火--用水浇灭 | D. | 油锅着火--用锅盖盖灭 |
(1)净水器中常用活性炭,主要利用它的吸附性;生活中常用肥皂水区分硬水和软水.
(2)配制3%的过氧化氢溶液500g用于消毒,需要30%的过氧化氢溶液50g.
(3)下表是KNO3、NaCl在不同温度时的溶解度.
| 温 度/℃ | 20 | 40 | 60 | 80 | |
| 溶解度/g | KNO3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 36.0 | 36.6 | 37.3 | 38.4 | |

①20℃,向100g水中加入50g KNO3,所得溶液为饱和(填“饱和”或“不饱和”);若要提高该溶液中溶质的质量分数,其方法是升温.
②若KNO3饱和溶液中有少量NaCl,可用降温(填“降温”或“蒸发”)结晶法提纯KNO3.
③图2所示,往含氢氧化钠固体的试管中加水,烧杯中出现浑浊,结合图1分析其原因:NaOH溶于水放热,使硒酸镉在水中溶解度变小.
| 选项 | 物质 | 加入的试剂和操作 | 基本反应类型 |
| A | CuO(Cu) | 适量稀盐酸,过滤 | 复分解反应 |
| B | CaO(CaCO3) | 高温煅烧 | 分解反应 |
| C | Cu(NO3)2溶液(AgNO3) | 过量锌粉,过滤 | 置换反应 |
| D | CO2(CO) | 氧气,点燃 | 化合反应 |
| A. | A | B. | B | C. | C | D. | D |