题目内容
在NH3、N2、N2O3、NO、HNO3这四种物质中,N元素表现出的化合价由低到高排列顺序 .
分析:根据在化合物中正负化合价代数和为零,单质中元素的化合价为零,结合的化学式进行解答本题.
解答:解:氢元素显+1价,设NH3中氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(+1)×3=0,则x=-3价.
单质中元素的化合价为零,因此氮气中氮元素的化合价为零;
氧元素显-2价,设N2O3中氮元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:2y+(-2)×3=0,则y=+3价.
氧元素显-2价,设NO中氮元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:z+(-2)=0,则z=+2价.
氢元素显+1价,氧元素显-2价,设HNO3中氮元素的化合价是m,根据在化合物中正负化合价代数和为零,可得:(+1)+m+(-2)×3=0,则m=+5价.
因此氮元素的化合价由低到高排列顺序为:NH3、N2、NO、N2O3、HNO3.
单质中元素的化合价为零,因此氮气中氮元素的化合价为零;
氧元素显-2价,设N2O3中氮元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:2y+(-2)×3=0,则y=+3价.
氧元素显-2价,设NO中氮元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:z+(-2)=0,则z=+2价.
氢元素显+1价,氧元素显-2价,设HNO3中氮元素的化合价是m,根据在化合物中正负化合价代数和为零,可得:(+1)+m+(-2)×3=0,则m=+5价.
因此氮元素的化合价由低到高排列顺序为:NH3、N2、NO、N2O3、HNO3.
点评:本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
现实生活中,氨气多用作致冷剂及农用化肥,其实它还是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气.最近,科学家用一种含钼的化合物作催化剂,在常温下就能完成氨的合成,从而大大降低了生产成本,使得液氨有望取代液氢成为新一代绿色能源.
(1)N2+3H2 2NH3该反应属于基本反应类型中的______反应.
2NH3该反应属于基本反应类型中的______反应.
(2)请你根据下表信息分析用NH3取代H2的优点:
①由于NH3比H2沸点高,所以更易______,便于储存和运输.
②NH3泄漏时易发现是因为______,同时它易溶于水,便于处理.
(1)N2+3H2
 2NH3该反应属于基本反应类型中的______反应.
2NH3该反应属于基本反应类型中的______反应.(2)请你根据下表信息分析用NH3取代H2的优点:
| 性质 名称 | 颜色、气味 | 熔点(℃) | 沸点(℃) | 25℃水中溶解度(g/L) | 标况下密度 (g/L) |
| NH3 | 无色、刺激性 | -77.7 | -33 | 456 | 0.6942 |
| H2 | 无色、无味 | -259.2 | -253 | 0.0015 | 0.0899 |
②NH3泄漏时易发现是因为______,同时它易溶于水,便于处理.
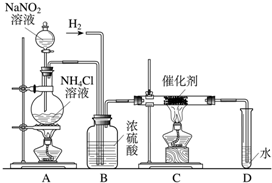
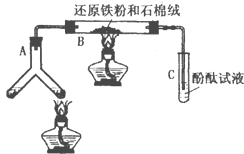 某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:
某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息: