题目内容
14.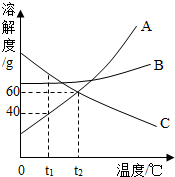 如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:(1)t1℃时,将20g的A物质加入到50g水中,充分溶解后,所得溶液是饱和(选填“饱和”或“不饱和”)溶液.
(2)室温下,将盛有B的饱和溶液的试管(底部有部分固体未溶解)放入盛水的烧杯中,再向烧杯内的水中加入一定量的CaO,并搅拌,试管内可以观察到的现象是固体逐渐溶解并消失,原因是氧化钙与水反应放出热量,B的溶解度随温度升高而增大.
(3)将t1℃时A和C的饱和溶液同时升高到t2℃后,所得溶液中溶质的质量分数的大小关系是A<C.
分析 (1)根据溶解度曲线可知,t1℃时,A的溶解度为40 g,则在该温度下,50 g水中最多溶解20 g A物质,将20 g A物质加入到50 g水中,所得溶液为饱和溶液;
(2)氧化钙溶于水时放出热量,B物质的溶解度增大,则剩余的固体会溶解并消失;
(3)升高温度时,C物质的溶解度减小,有晶体析出,溶质质量分数减小,A物质的溶解度增大,溶液变为不饱和溶液,但溶质质量分数不变,并结合饱和溶液中溶质的质量分数计算方法解答.
解答 解:
(1)t1℃时,A的溶解度为40 g,既则在该温度下,100 g水中最多溶解40 g A物质,则50g水中最多溶解20g的A,所以将20 g A物质加入到50 g水中,恰好为饱和溶液;
(2)氧化钙溶于水时放出热量,而B的溶解度随温度升高而增大,B物质的溶解度增大,则剩余的固体会逐渐溶解并消失;
(3)升高温度时,C物质的溶解度减小,有晶体析出,溶质质量分数减小,A物质的溶解度增大,溶液变为不饱和溶液,但溶质质量分数不变,饱和时质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,即饱和溶液中溶解度大则溶质的质量分数大,而升温后C的 溶解度大于升温前A的溶解度,故所得溶液的溶质质量分数A<C;
故答案为:
(1)饱和; (2)固体逐渐溶解并消失;氧化钙与水反应放出热量,B的溶解度随温度升高而增大;(3)A<C.
点评 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以培养学生应用知识解决问题的能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
2.如图粒子结构示意图中,表示阴离子的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列家庭常用物质中,属于纯净物的是( )
| A. | 黄金 | B. | 食醋 | C. | 蒸馏水 | D. | 红牛 |
19.种植水果、蔬菜少不了化肥,下列化肥中属于氮肥的是( )
| A. | KC1 | B. | CaSO4 | C. | Ca(H2PO4)2 | D. | CO(NO2)2 |
7.下列实验现象的描述中正确的是( )
| A. | 碳在氧气中燃烧发出红光 | |
| B. | 红磷在空气中燃烧产生大量浓厚的白雾 | |
| C. | 一氧化碳在空气中燃烧发出淡蓝色火焰 | |
| D. | 铁在氧气中剧烈燃烧、火星四射 |
8.下列关于水的说法正确的是( )
| A. | 淡水资源取之不尽、用之不竭 | |
| B. | 长期饮用硬水对身体有害,应多饮用纯净水 | |
| C. | 合理施用农药、化肥,以减少水体污染 | |
| D. | 水是由氢原子和氧原子构成的 |
