题目内容
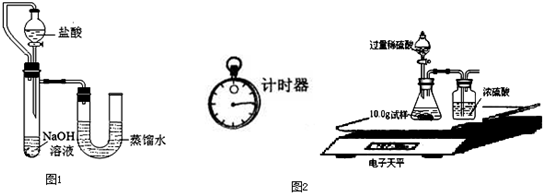
(14分)某同学为了研究酒精的性质,做了如下探究,请你把他的探究情况完成。
(1)通过观察酒精灯内的酒精,酒精的颜色是________ __,状态____ ______;
(2)闻闻它的气味,酒精___________气味;
(3)用滴管吸取一些酒精滴入盛有少量水的试管中,可见酒精_ (“溶”或“不溶”)于水;
(4)用火柴点燃酒精灯,然后把干燥的冷烧杯罩在酒精灯的火焰上方,发现烧杯内壁_______ ___,把烧杯倒立过来立即注入少量澄清石灰水,振荡后发现石灰水____ ___,通过这两个现象说明酒精燃烧时生成水和二氧化碳,该反应的文字表达式为 。
(1)无色 液体 (2)有特殊 (3)溶 (4)有水雾 变浑浊
酒精+氧气  水+二氧化碳。
水+二氧化碳。
【解析】略

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案(14分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
①该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
③生产原理:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体A,并使其充分受热,即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 。
④氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑。
⑤部分生产流程如下图所示:
【问题讨论】
(1)溶液A中的溶质有NaCl和 、 ,操作Ⅱ的名称为 。
(2)上述流程中NaOH溶液的作用是除去粗盐中的 。
(3)写出加入Na2CO3溶液所发生反应的化学方程式 。
(4)上述生产流程中可循环使用的是 (填序号)。
| A.CO2 | B.NH3 | C.HCl | D.NaOH |
| 实验步骤 | 实验现象 | 实验结论 |
| | | |
称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
(6)由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
同学们为了测定该纯碱样品的纯度(假定只有(6)中的杂质),设计了如下实验:
(7)甲组实验:取10.0 g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。计算样品中碳酸钠的质量分数为(写出计算过程,结果保留一位小数)。
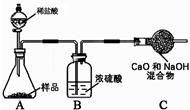
(8)乙组实验:取10.0 g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量)。实验结束后,发现乙组测定的碳酸钠质量分数偏小,其原因是 。
(14分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
①该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
③生产原理:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体A,并使其充分受热,即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 。
④氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑。
⑤部分生产流程如下图所示:

【问题讨论】
(1)溶液A中的溶质有NaCl和 、 ,操作Ⅱ的名称为 。
(2)上述流程中NaOH溶液的作用是除去粗盐中的 。
(3)写出加入Na2CO3溶液所发生反应的化学方程式 。
(4)上述生产流程中可循环使用的是 (填序号)。
A.CO2 B.NH3 C.HCl D.NaOH
(5)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠:
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
|
【组成确定】
称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
(6)由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
同学们为了测定该纯碱样品的纯度(假定只有(6)中的杂质),设计了如下实验:
(7)甲组实验:取10.0 g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。计算样品中碳酸钠的质量分数为(写出计算过程,结果保留一位小数)。
(8)乙组实验:取10.0 g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量)。实验结束后,发现乙组测定的碳酸钠质量分数偏小,其原因是 。