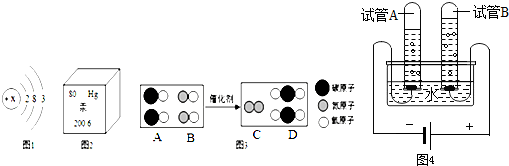
题目内容
 如图为某化学的微观过程,其“
如图为某化学的微观过程,其“ ”和“
”和“ ”表示两种不同的原子.
”表示两种不同的原子.
(1)该反应中反应物________(填“可能”或“不可能”)是氧化物,该反应属于________反应(填基本反应类型).
(2)图中方框内对应的微观图示是________(选A、B、C、D),你推断的依据是________.

解:(1)由反应物的微观构成可知,反应物是由两种元素组成的,如果一种元素是氧元素,就是氧化物.由化学的微观过程可知,该反应由一种物质生成了两种物质,该反应属于分解反应;
(2)反应前反应物的两个分子中含有4个 原子和两个
原子和两个 原子;而反应后只有4个
原子;而反应后只有4个 原子;根据化学变化前后原子种类、数目不变,因此,框内物质的分子应由两个
原子;根据化学变化前后原子种类、数目不变,因此,框内物质的分子应由两个 原子构成,即图D所示的分子;
原子构成,即图D所示的分子;
故答为:(1)可能,分解;(2)D.
分析:(1)根据反应物的微观构成分析物质的类别,根据反应的特点分析反应的类型;
(2)根据质量守恒定律反应前后原子的种类及数目不变分析方框内对应的微观图示.
点评:解答本题的关键是要充分理解图中的信息,并分清分子的有关结构,只有这样才能对问题做出正确的判断.
(2)反应前反应物的两个分子中含有4个
 原子和两个
原子和两个 原子;而反应后只有4个
原子;而反应后只有4个 原子;根据化学变化前后原子种类、数目不变,因此,框内物质的分子应由两个
原子;根据化学变化前后原子种类、数目不变,因此,框内物质的分子应由两个 原子构成,即图D所示的分子;
原子构成,即图D所示的分子;故答为:(1)可能,分解;(2)D.
分析:(1)根据反应物的微观构成分析物质的类别,根据反应的特点分析反应的类型;
(2)根据质量守恒定律反应前后原子的种类及数目不变分析方框内对应的微观图示.
点评:解答本题的关键是要充分理解图中的信息,并分清分子的有关结构,只有这样才能对问题做出正确的判断.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:______.
(2)简述强调“测得的pH小于7”的理由:______.
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再不断滴加盐酸,一段时间后可观察到红色消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是______.实验结果表明酚酞溶液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈______性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳______(填“有关”或“无关”).
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法:______,②观察到的现象______.
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表).
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |

(1)表中x=______.
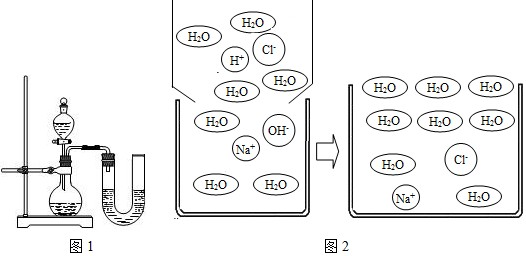
(2)某同学在没使用温度计的情况下,通过如图1所示装置完成了实验.则该同学根据______判断NaOH溶液与稀盐酸发生了中和反应.但有同学认为单凭此现象不足以说明该反应放热,其理由是______.
(3)对上述过程采用微观模型加以认识,如图2:
①氢氧化钠溶液与盐酸反应中消失的离子有:______
②上图微观模型所反映的NaCl溶液溶质的质量分数(保留至0.1%):______.