题目内容
为测定某温度时![]() 的溶解度,先称取
的溶解度,先称取![]() 晶体,然后在烧杯中加入100g水,分次慢慢加入少量
晶体,然后在烧杯中加入100g水,分次慢慢加入少量![]() 晶体直至不再溶解,称得剩余
晶体直至不再溶解,称得剩余![]() 晶体18g,则该温度时
晶体18g,则该温度时![]() 晶体在水中的溶解度为
晶体在水中的溶解度为
A.18g
B.36g
C.82g
D.100g

 名校课堂系列答案
名校课堂系列答案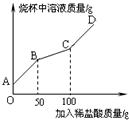 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺

(2)“降温”的目的是析出副产品“A晶体”,A的化学式是________;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱.在整个生产工艺中没有涉及到的基本反应类型是________,可重复利用的是________(水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是________.
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质________(写化学式).
(四)含量测定
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌.先发生反应:Na2CO3+HCl=NaHCO3+NaCl;后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量________.
(7)请通过计算并结合表判断此纯碱样品等级为________品.
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
金属材料和水在生产和生活中有着广泛应用.
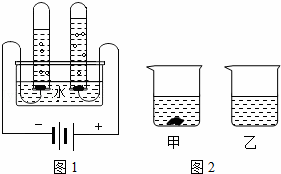
(1)如图1是水的组成测定的实验,此反应的方程式为 .
(2)水是很好的溶剂.下表是KNO3和KCl在不同温度时的溶解度,请回答下列问题:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
|
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
①40℃时,向两个分别盛有45g KNO3和KCl固体的烧杯中,各加入100g的水,充分溶解后,结果如图2所示,则乙烧杯中的溶质是 .
②采用任意一种操作方法,将上述烧杯中的剩余固体全部溶解,并将溶液变为不饱和溶液.下列说法中正确的是 (填字母).
A.溶剂质量可能不变 B.溶液中溶质的质量分数一定增大
C.溶液质量一定增大 D.可采用升温或加水的方法
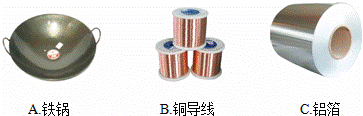
(3)从下图可知金属具有导热性的是 .
(4)铁制品在空气中会发生锈蚀,其原因是铁与空气中的 共同作用的结果.为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是 (要求一种方法即可).
(5)在探究金属的化学性质时,某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 、 .
(6)小明向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,待充分反应后,滤液呈浅绿色.根据此现象作出了下列判断,你认为正确的是 (填写序号).
A.滤纸上一定有Cu,可能有Fe,一定没有Mg
B.滤纸上一定有Fe,可能有Mg、Cu
C.滤液中一定有FeSO4,可能有MgSO4、CuSO4
D.滤液中一定有MgSO4、FeSO4,一定没有CuSO4.
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.

