题目内容
(6分)化学是一门以实验为基础的自然科学。依据实验目的设计切实可行的的实验方案是科学探究中的重要环节。
甲 乙 丙
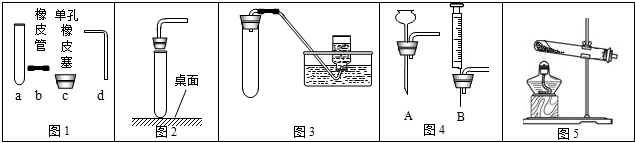
(1)用甲装置测定水的组成。a试管中气体能燃烧,该气体是___,正极与负极产生气体的质量比为_____。甲装置中发生反应的化学方程式为__________________。
(2)小红同学用乙装置进行探究实验,观察现象得出结论。
①蜡烛中含有氢元素,她依据的现象是 ______________________ 。
②一段时间后,小红观察到蜡烛熄灭,由此得出可燃物燃烧必须具备的条件是 。
(3)用丙装置测定空气中氧气的含量。下列有关该实验的说法中,正确的是 (填
字母序号)。
| A.实验时红磷一定要足量 | B.点燃红磷前先用弹簧夹夹紧乳胶管 |
| C.红磷熄灭后立刻打开弹簧夹 | D.最终进入瓶中水的体积约为消耗氧气的体积 |
(1)氢气(或H2) 8:1 2H2O  2H2↑ +O2↑
2H2↑ +O2↑
(2)①烧杯内壁上有水雾 ②与氧气接触
(3)ABD
解析试题分析:(1)电解水时,正极产生的是氧气,负极产生的是氢气,氧气与氢气的体积比是1:2;质量比是8:1;a试管中气体能燃烧,该气体是氢气,正极与负极产生气体的质量比为8:1。甲装置中发生反应的化学方程式为2H2O  2H2↑ +O2↑。
2H2↑ +O2↑。
(2)①蜡烛中含有氢元素,她依据的现象是烧杯内壁上有水雾。
②一段时间后,小红观察到蜡烛熄灭,由此得出可燃物燃烧必须具备的条件是与氧气接触。
(3)用丙装置测定空气中氧气的含量。实验所用的红磷一定要足量;点燃红磷前先用弹簧夹夹紧乳胶管;最终进入瓶中水的体积约为消耗氧气的体积。
考点:电解水;化学方程式;物质的组成;燃烧法测定空气中氧气的体积分数。
点评:电解水时,正极产生的是氧气,负极产生的是氢气,氧气与氢气的体积比是1:2;质量比是8:1;书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号;燃烧法测定空气中氧气的体积分数,实验所用的红磷一定要足量、点燃红磷前先用弹簧夹夹紧乳胶管、装置不能漏气、要等到装置冷却后再打开止水夹。
空气中含有21%体积的氧气,约占总体积的1/5。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
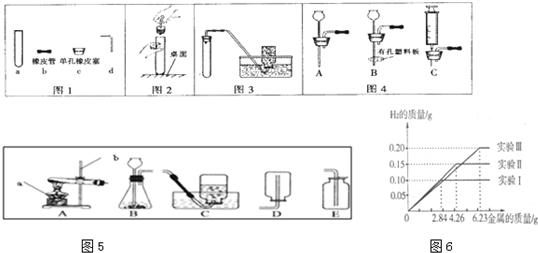
 20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答:
20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答: