题目内容
 如图为某化学反应的微观模型示意图,其中分析错误的是
如图为某化学反应的微观模型示意图,其中分析错误的是
- A.反应前后原子种类、数目没有变化
- B.反应的本质是分子的破裂,原子的重新组合过程
- C.反应中各物质的分子个数比例是1:1:1:1
- D.此反应时分解反应
CD
分析:根据化学反应的微观模型示意图,观察分析分子的构成,原子的种类,物质的种类,在化学反应中,分子、原子的变化;根据反应物、生成物的种类及反应的特点,分析反应的类型.
解答:物质实际转化关系如图:
A、由反应的微观变化过程示意图看出,该反应中各物质的分子个数比应是4:3:2:6,根据各物质的分子个数比得出该变化前后原子种类、数目没有变化,故A正确;
B、由反应的微观变化过程示意图看出,反应前后分子的种类发生了变化,原子种类、数目没有变化,原子结合方式发生改变,可得出反应的本质是分子的破裂,原子的重新组合的过程,故B正确;
C、由反应的微观变化过程示意图看出,反应中各物质的分子个数比例是4:3:2:6,故C错误;
D、由反应的微观变化过程示意图看出,反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应,故D错误.
故选:CD.
点评:该题不仅考查了学生对化学知识的掌握情况,还考查了学生观察理解微观模型示意图的能力,从多方面考查了学生的综合能力.
分析:根据化学反应的微观模型示意图,观察分析分子的构成,原子的种类,物质的种类,在化学反应中,分子、原子的变化;根据反应物、生成物的种类及反应的特点,分析反应的类型.
解答:物质实际转化关系如图:

A、由反应的微观变化过程示意图看出,该反应中各物质的分子个数比应是4:3:2:6,根据各物质的分子个数比得出该变化前后原子种类、数目没有变化,故A正确;
B、由反应的微观变化过程示意图看出,反应前后分子的种类发生了变化,原子种类、数目没有变化,原子结合方式发生改变,可得出反应的本质是分子的破裂,原子的重新组合的过程,故B正确;
C、由反应的微观变化过程示意图看出,反应中各物质的分子个数比例是4:3:2:6,故C错误;
D、由反应的微观变化过程示意图看出,反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应,故D错误.
故选:CD.
点评:该题不仅考查了学生对化学知识的掌握情况,还考查了学生观察理解微观模型示意图的能力,从多方面考查了学生的综合能力.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
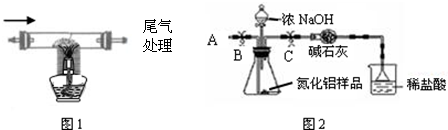
氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
实验二:测定所制氮化铝样品中氮化铝的质量分数
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查 .
(2)装有碱石灰的干燥管作用是 ;装置中使用漏斗的目的是 .
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是 ;图2烧杯中稀盐酸不能换成浓硫酸的理由是 ;图2烧杯中稀盐酸能否换成稀硫酸 .
(4)步骤④的目的是 .
实验结论:所制氮化铝样品中氮化铝的质量分数为 %(写计算过程,4分).
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是: .
拓展探究:(1)实验后剩余的浓NaOH溶液 (能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式 .
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液 g(写计算过程,4分).
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 | ||||
| 1.除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为 2Cu+O2
| ||||
| 2.用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3
|
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查
(2)装有碱石灰的干燥管作用是
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是
(4)步骤④的目的是
实验结论:所制氮化铝样品中氮化铝的质量分数为
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:
拓展探究:(1)实验后剩余的浓NaOH溶液
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液

 37、如图所示,某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否完全反应,该同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是他得出“两种物质已恰好完全中和”的结论.
37、如图所示,某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否完全反应,该同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是他得出“两种物质已恰好完全中和”的结论.
 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.