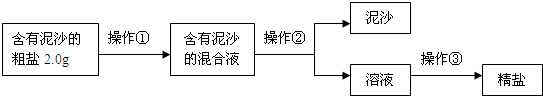
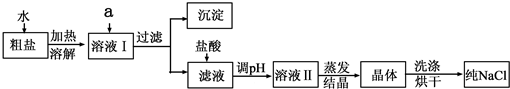
题目内容
有200g某质量分数的硫酸溶液恰好与32.5g锌完全反应,求此硫酸溶液中溶质的质量分数和所得溶液中溶质的质量分数。
答案:
解析:
提示:
解析:
| 解:计算溶质的质量分数必须知道溶质质量和溶液质量。因为化学反应在溶液中的溶质间进行,所以根据化学方程式可求出溶质的质量。硫酸溶液的质量已知,故代入公式便可求出硫酸溶液中溶质的质量分数。而硫酸锌溶液的质量可以通过两种方法计算:①参加反应的锌与硫酸溶液的质量之和减去放出氢气的质量;②硫酸锌的质量与硫酸锌溶液中所含水的质量之和,则问题便可得到解答:
设参加反应的纯硫酸的质量为x,生成硫酸锌的质量为y,生成氢气的质量为z。 Zn+H2SO4 65 98 161 2 32.5g x y z 65∶98=32.5g∶x,x=49g 65∶161=32.5g∶y,y=80.5g 65∶2=32.5g∶z,z=1g ①硫酸溶液中溶质的质量分数= ②硫酸锌溶液中溶质的质量分数= 也有另一种解法:硫酸中水的质量为:200-49=151(g),生成物中没有水,则硫酸锌溶液中的含水量就是硫酸溶液中的含水量。硫酸锌溶液中溶质的质量分数:
|
提示:

练习册系列答案
相关题目