题目内容
为测定NaCl、Na2CO3固体混合物组成.某化学课外小组取29g该混合物于烧杯中,分五次加入稀盐酸(每次50g).实验所得数据如下表:| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀盐酸的质量 | 50g | 50g | 50g | 50g | 50g |
| 烧杯和烧杯内物质的总质量 | 159.1g | 206.9g | 254.7g | 302.5g | 352.5g |
②实验完毕后,溶液中NaCl的质量分数(以上计算结果均保留一位小数).
分析:NaCl、Na2CO3固体混合物中滴加盐酸,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;二氧化碳放出使反应前后总质量减小;完全反应后所得溶液为氯化钠溶液,其中溶质氯化钠为原混合固体物中氯化钠质量与反应生成氯化钠质量之和;
第二次反应前后烧杯和烧杯内物质的总质量差=159.1g+50g-206.9g=2.2g;
第三次反应前后烧杯和烧杯内物质的总质量差=206.9g+50g-254.7g=2.2g;
第四次反应前后烧杯和烧杯内物质的总质量差=254.7g+50g-302.5g=2.2g;
第五次反应前后烧杯和烧杯内物质的总质量差=302.5g+50g-352.5g=0;说明第四次混合物中的碳酸钠已完全反应,前四次反应每次反应放出2.2g二氧化碳,四次反应共放出二氧化碳的质量=(159.1g+50g-206.9g)×4=8.8g;
根据反应的化学方程式,利用反应生成二氧化碳气体的质量可计算反应消耗碳酸钠的质量和生成氯化钠的质量.
第二次反应前后烧杯和烧杯内物质的总质量差=159.1g+50g-206.9g=2.2g;
第三次反应前后烧杯和烧杯内物质的总质量差=206.9g+50g-254.7g=2.2g;
第四次反应前后烧杯和烧杯内物质的总质量差=254.7g+50g-302.5g=2.2g;
第五次反应前后烧杯和烧杯内物质的总质量差=302.5g+50g-352.5g=0;说明第四次混合物中的碳酸钠已完全反应,前四次反应每次反应放出2.2g二氧化碳,四次反应共放出二氧化碳的质量=(159.1g+50g-206.9g)×4=8.8g;
根据反应的化学方程式,利用反应生成二氧化碳气体的质量可计算反应消耗碳酸钠的质量和生成氯化钠的质量.
解答:解:由题意,第四次实验正好完全反应,实验完毕后生成二氧化碳的质量=(159.1g+50g-206.9g)×4=8.8g
设原混合物中碳酸钠的质量为x,它与稀盐酸反应生成的氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
=
x=21.2g
=
y=23.4g
(1)原混合物中Na2CO3的质量分数=
×100%=73.1%
(2)实验完毕后,溶液中NaCl的质量分数=
×100%=11.5%
答:①原混合物中Na2CO3的质量分数为73.1%;
②实验完毕后,溶液中NaCl的质量分数为11.5%.
设原混合物中碳酸钠的质量为x,它与稀盐酸反应生成的氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
| 106 |
| x |
| 44 |
| 8.8g |
| 117 |
| y |
| 44 |
| 8.8g |
(1)原混合物中Na2CO3的质量分数=
| 21.2g |
| 29g |
(2)实验完毕后,溶液中NaCl的质量分数=
| 23.4g+(29g-21.2g) |
| 29g+250g-8.8g |
答:①原混合物中Na2CO3的质量分数为73.1%;
②实验完毕后,溶液中NaCl的质量分数为11.5%.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物质量+五次所加稀盐酸的质量-放出二氧化碳的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺

(2)“降温”的目的是析出副产品“A晶体”,A的化学式是________;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱.在整个生产工艺中没有涉及到的基本反应类型是________,可重复利用的是________(水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是________.
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质________(写化学式).
(四)含量测定
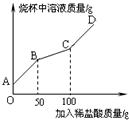
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌.先发生反应:Na2CO3+HCl=NaHCO3+NaCl;后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量________.
(7)请通过计算并结合表判断此纯碱样品等级为________品.
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
 (2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
