题目内容
17.称取5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应(生铁样品中的杂质不溶于水也不与盐酸发生反应),产生0.2g氢气.试计算反应后所得溶液中溶质的质量分数.分析 根据铁与稀盐酸反应的化学方程式和生成的气体质量,列出比例式,即可计算出参加反应铁的质量和生成氯化亚铁质量;根据溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%计算即可.
解答 解:生成氢气的质量为0.2g;
设参加反应铁的质量为x,生成氯化亚铁质量为y
Fe+2HCl=FeCl2+H2↑
56 127 2
x y 0.2g
$\frac{56}{x}=\frac{127}{y}=\frac{2}{0.2g}$
解之得:x=5.6g,y=12.7g
反应后的溶液中溶质的质量分数为:$\frac{12.7g}{5.6g+94.6g-0.2g}$×100%=12.7%.
答案:反应后的溶液中溶质的质量分数为12.7%.
点评 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
7.某学习小组对粗盐中杂质(难溶性和可溶性)的去除展开相关探究.
(1)粗盐中难溶性杂质去除的实验步骤为①溶解,②过滤,③蒸发(写操作名称),④计算产率.
(2)步骤②中需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗(写仪器名称),其中玻璃棒的作用是引流.
(3)【提出猜想】
甲同学:该粗盐中含有难溶性杂质外,是否还含有可溶性杂质?
(4)【查阅资料】
①粗盐中可能含有镁盐(Mg2+)和硫酸盐(SO42-)等可溶性杂质.
②一些物质的溶解性表
说明:“溶”表示该物质可溶于水,“不”表示该物质不溶于水.
③Mg(OH)2为白色物质,不溶于氢氧化钠溶液;BaSO4为白色物质,不溶于盐酸;
MgCO3,BaCO3为白色物质都能溶于盐酸.
(5)【实验设计】
①取少量除去难溶性杂质后的盐,溶于水配成溶液.
②取少量所配溶液于试管中,滴加氢氧化钠溶液,产生白色沉淀,继续滴加氢氧化钠溶液,沉淀不溶,说明该盐含有可溶性的镁盐.
③另取少量所配溶液于试管中,滴加氯化钡溶液,产生白色沉淀,再加稀盐酸,沉淀不溶,说明该盐含有可溶性的硫酸盐.
(6)【实验结论】该盐含有可溶性杂质硫酸镁.
(7)【实验拓展】以下为乙同学设计的去除食盐中可溶性杂质的试验流程:
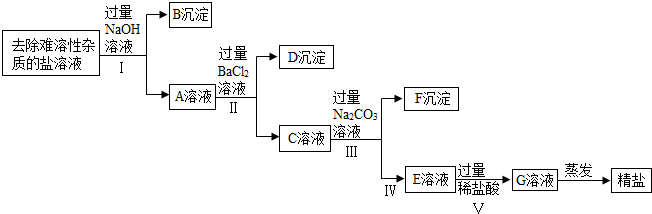
①该实验过程中,除杂试剂都要过量,原因是将杂质完全除去.
②过量Na2CO3溶液用来除Ba2+离子(填离子序号).
(1)粗盐中难溶性杂质去除的实验步骤为①溶解,②过滤,③蒸发(写操作名称),④计算产率.
(2)步骤②中需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗(写仪器名称),其中玻璃棒的作用是引流.
(3)【提出猜想】
甲同学:该粗盐中含有难溶性杂质外,是否还含有可溶性杂质?
(4)【查阅资料】
①粗盐中可能含有镁盐(Mg2+)和硫酸盐(SO42-)等可溶性杂质.
②一些物质的溶解性表
| 阳离子 阴离子 | OH- | CL- | SO${\;}_{4}^{2-}$ | CO${\;}_{3}^{2-}$ |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
③Mg(OH)2为白色物质,不溶于氢氧化钠溶液;BaSO4为白色物质,不溶于盐酸;
MgCO3,BaCO3为白色物质都能溶于盐酸.
(5)【实验设计】
①取少量除去难溶性杂质后的盐,溶于水配成溶液.
②取少量所配溶液于试管中,滴加氢氧化钠溶液,产生白色沉淀,继续滴加氢氧化钠溶液,沉淀不溶,说明该盐含有可溶性的镁盐.
③另取少量所配溶液于试管中,滴加氯化钡溶液,产生白色沉淀,再加稀盐酸,沉淀不溶,说明该盐含有可溶性的硫酸盐.
(6)【实验结论】该盐含有可溶性杂质硫酸镁.
(7)【实验拓展】以下为乙同学设计的去除食盐中可溶性杂质的试验流程:

①该实验过程中,除杂试剂都要过量,原因是将杂质完全除去.
②过量Na2CO3溶液用来除Ba2+离子(填离子序号).
5.已知反应4FeS2+xO2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.下列说法正确的是( )
| A. | 反应前后氧元素的化合价不变 | B. | 此反应属于复分解反应 | ||
| C. | x为11 | D. | 反应前后固体质量不变 |
2.判断下列化学方程式中,属于分解反应的是( )
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | Fe+CuSO4═FeSO4+Cu |
9.下列说法或做法正确的是( )
| A. | 森林发生火灾时,可砍掉部分树木形成隔离带 | |
| B. | 糖类、蛋白质、水、维生素、甲醛和硝酸铅,它们通常被称为六大基本营养素 | |
| C. | 为了提高农作物产量,应大量使用农药和化肥 | |
| D. | 为了节省能源,冬天烤炭火时紧闭门窗 |
6.“五月粽香飘万家”,能闻到粽香的原因是( )
| A. | 分子是由原子构成的 | B. | 分子的质量和体积都很小 | ||
| C. | 分子在不停地运动 | D. | 分子间有间隔 |
7.下列化学用语与所表达的意义对应错误的是( )
| A. | Mg-金属镁 | B. |  -镁原子 -镁原子 | ||
| C. | $\stackrel{+2}{Mg}$O-氧化镁中镁元素为+2价 | D. | N2-1个氮分子由2个氮原子构成 |

 如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.