题目内容
 为测定假黄金(铜锌合金)组成元素的质量分数,现称取20g假黄金置于烧杯中,用某浓度的稀盐酸50g加入烧杯充分反应.
为测定假黄金(铜锌合金)组成元素的质量分数,现称取20g假黄金置于烧杯中,用某浓度的稀盐酸50g加入烧杯充分反应.(1)铜锌合金中锌的质量分数是
32.5%
32.5%
.(2)由图可知,当加入稀盐酸的质量为
40
40
g时,表明锌恰好完全溶解.(3)求所用稀盐酸中溶质的质量分数?
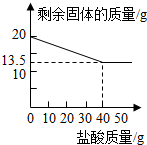
分析:(1)根据图象可知,剩余固体的质量当减少到13.5g时不再减少,说明剩余固体是铜,根据铜的质量和假黄金的质量可以计算出合金中锌的质量分数;
(2)根据图象可知,当加入盐酸的质量为40g时,剩余固体的质量不再减少,表明锌恰好完全溶解;
(4)根据锌与盐酸反应的方程式,由锌的质量可求出参加反应的盐酸中溶质的质量,再根据溶质质量分数的计算公式求出所用稀盐酸中溶质的质量分数.
(2)根据图象可知,当加入盐酸的质量为40g时,剩余固体的质量不再减少,表明锌恰好完全溶解;
(4)根据锌与盐酸反应的方程式,由锌的质量可求出参加反应的盐酸中溶质的质量,再根据溶质质量分数的计算公式求出所用稀盐酸中溶质的质量分数.
解答:解:(1)由图象可知,剩余固体的质量当减少到13.5g时不再减少,说明剩余固体是铜,参加反应的锌的质量为:20g-13.5g=6.5g,则铜锌合金中锌的质量分数是:
×100%=32.5%
(2)由图象可知,当加入盐酸的质量为40g时,剩余固体的质量不再减少,表明锌恰好完全溶解;
(3)设40g的盐酸中溶质的质量为X
Zn+2HCl=ZnCl2+H2↑
65 73
6.5g x
=
解得:X=7.3g
所用稀盐酸中溶质的质量分数是:
×100%=18.25%
答:(1)32.5%;(2)40;(3)所用稀盐酸中溶质的质量分数18.25%.
| 6.5g |
| 20g |
(2)由图象可知,当加入盐酸的质量为40g时,剩余固体的质量不再减少,表明锌恰好完全溶解;
(3)设40g的盐酸中溶质的质量为X
Zn+2HCl=ZnCl2+H2↑
65 73
6.5g x
| 65 |
| 73 |
| 6.5g |
| X |
所用稀盐酸中溶质的质量分数是:
| 7.3g |
| 40g |
答:(1)32.5%;(2)40;(3)所用稀盐酸中溶质的质量分数18.25%.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力,解题时要知道铜与稀盐酸不反应,铜锌合金与稀盐酸的反应,为锌与稀盐酸的反应,然后根据化学方程式进行计算,问题即可迎刃而解.

练习册系列答案
相关题目
 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| 1 | 10 | 18.375 |
| 2 | 10 | 16.750 |
| 3 | 10 | 15.125 |
| 4 | 10 | 13.500 |
| 5 | 10 | 13.500 |
(2)计算稀盐酸中溶质的质量分数;
(3)当合金中的锌与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为多少?
 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| 1 | 10 | 18.375 |
| 2 | 10 | 16.750 |
| 3 | 10 | 15.125 |
| 4 | 10 | 13.500 |
| 5 | 10 | 13.500 |
(2)从图可知,当所用合金与稀盐酸的质量比为
(3)计算稀盐酸中溶质的质量分数.
 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下: 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,逐渐加入50克某浓度的稀盐酸.充分反应后,取出剩余固体,经过滤、干燥等操作后称量,剩余固体质量与所加盐酸的质量关系如图:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,逐渐加入50克某浓度的稀盐酸.充分反应后,取出剩余固体,经过滤、干燥等操作后称量,剩余固体质量与所加盐酸的质量关系如图: