题目内容
15.我们知道,高温煅烧石灰石(主要成份是碳酸钙)可制得生石灰(即氧化钙)和二氧化碳.为了分析产品的纯度,小舜同学取石灰石样品22g,充分煅烧后称得剩余固体的质量为13.2g(提示:假定杂质不反应).计算:(1)生成二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是多少?
分析 (1)石灰石中碳酸钙高温下分解放出的二氧化碳使剩余固体质量减小,因此可利用质量守恒定律,求得分解放出二氧化碳的质量;
(2)石灰石样品的纯度即石灰石样品中碳酸钙的质量分数,根据分解反应的化学方程式,由放出二氧化碳的质量计算出样品中所含碳酸钙的质量,求出石灰石样品中碳酸钙的质量分数.
解答 解:(1)由质量守恒定律可知生成CO2的质量为:22g-13.2g=8.8g,
(2)设22g石灰石样品中含CaCO3的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 44
x 8.8g
$\frac{100}{x}=\frac{44}{8.8g}$
x=20g
该石灰石中碳酸钙的质量分数=$\frac{20g}{22g}$×100%=90.9%
答案:(1)生成二氧化碳的质量为8.8g;(2)石灰石中碳酸钙的质量分数是90.9%.
点评 解答时需要注意,剩余固体质量并非氧化钙的质量,其中还含有杂质,因此不能把此数据代入化学方程式进行碳酸钙质量的计算.

练习册系列答案
相关题目
5.对人体吸入的空气和呼出气体的探究
[结论]人呼出的气体比吸入气体含量变多的气体是二氧化碳、水蒸气,变少的是氧气.
| 探究步骤 | 现象 | 分析或结论 | |
| 1、用排水法收集两瓶呼出的气体 | |||
| 2、 检 验 气 体 的 组 成 | (1)取一瓶空气和一瓶呼出的气体,分别滴入澄清石灰水 | 空气:石灰水无明显变化 呼出气体:石灰水变浑浊 | 呼出气体中CO2 的含量比空气中多 |
| (2)空气和一瓶呼出的气体,分别插入燃着的小木条 | 空气:木条燃烧无明显变化 呼出气体:木条熄灭 | 呼出气体中O2含量比空气中少 | |
| (3)两块干燥的玻璃片,对其中的一块呼气 | 呼出的一块上可看到: 水雾 | 呼出气体中水分含量比空气中多 | |
20.某同学用托盘天平称取8.5克某固体药品,称取过程中发现指针向右偏,则他应该( )
| A. | 增加砝码 | B. | 增加药品 | C. | 减少砝码 | D. | 减少药品 |
7.下列关于催化剂的说法中,正确的是( )
| A. | 只有二氧化锰能做催化剂 | |
| B. | 催化剂加快反应速率 | |
| C. | 催化剂不能减缓反应速率 | |
| D. | 反应前后催化剂的化学性质不会改变 |
4.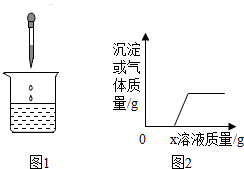 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )| 烧杯中的物质 | x溶液 | |
| A | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |
| B | 需硫酸和稀盐酸 | 氯化钡溶液 |
| C | 黄铜粉末 | 稀盐酸 |
| D | 稀盐酸和硫酸镁溶液 | 烧碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
 如图是某同学制作的简易净水器,请回答下列问题:
如图是某同学制作的简易净水器,请回答下列问题: 如图,将正在萌发的种子,放在内有一杯NaOH溶液而用塞子塞紧的瓶中,此瓶与一个水银流体压力计相连接,由此压力计水银柱升高的高度可以测量出某种气体的消耗量.假设正在萌发的种子用完了瓶中所有的气体,则水银柱会升高到76cm处(等于大气压).
如图,将正在萌发的种子,放在内有一杯NaOH溶液而用塞子塞紧的瓶中,此瓶与一个水银流体压力计相连接,由此压力计水银柱升高的高度可以测量出某种气体的消耗量.假设正在萌发的种子用完了瓶中所有的气体,则水银柱会升高到76cm处(等于大气压).