题目内容
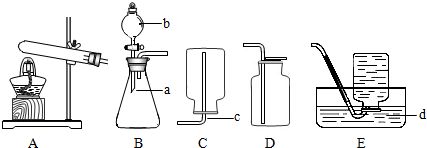
下列操作中仪器不应接触的是
[ ]
A.向试管内倾倒液体时,试管口与试剂瓶口
B.过滤时,玻璃棒与漏斗内的滤纸
C.搅拌时,玻璃棒与烧杯内壁
D.用滴管滴加液体时,滴管与容器口
答案:CD
解析:
解析:
|
思路分析:往试管中倾注液体时,先打开试剂瓶塞,将瓶塞倒放在桌面上,手心对准标签拿起试剂瓶,另一只手持试管并让试管向试剂瓶方向略倾斜,使瓶口紧挨试管口,使液体缓缓地注入试管内.倒出所需量的液体后,将试剂瓶口在试管口上刮一下,(这一蹭是为了避免留在瓶口的液体流到试剂瓶外壁)再将试剂瓶放下,立即盖好瓶塞,标签向外放回原处. 从烧杯中把要过滤的液体(烧杯中所盛的浑浊液体)倒入过滤器的漏斗中,属于往大口容器中倾注液体,应当用玻璃棒引流.倾注液体时,烧杯嘴应当紧靠玻璃棒,使浑浊液体沿着玻璃棒流入过滤器里.玻璃棒的底端要与过滤器漏斗中有三层滤纸处轻轻接触. 搅拌可以加快固体物质的溶解,也可加快两种液体均匀混合.一般用玻璃棒进行搅拌.在烧杯内进行搅拌时,使玻璃棒在溶液中沿同一方向做圆周运动,转速不要太快,不要使溶液形成旋涡,也不要向相反方向转动.(以免液体迸溅到容器外边)自始至终都要保持均匀、平稳,不能让玻璃棒碰及烧杯内壁. 用滴管滴加液体时,应使滴管口位于容器口稍上方且居正中,不可伸入容器内,也不可接触器壁. |

练习册系列答案
相关题目