题目内容
3.化学的学科特征是在分子、原子水平上研究物质和创造物质.请根据图示回答下列问题:
(1)图1中能说明分子之间有间隔的是甲(选填“甲”或“乙”).
(2)图2中,反应后示意的物质是混合物(选填“纯净物”或“混合物”),该反应中没有发生改变的粒子是氢原子、氧原子.
分析 (1)根据探究实验的目的来分析;
(2)根据微观反应示意图的信息来分析.
解答 解:(1)甲推动活塞,气体体积变小,说明分子间存在着间隔;而乙是探究了分子在不断地运动;故填:甲;
(2)由图示可知,反应后存在两种分子,所以宏观构成两种物质,属于混合物;原子是化学变化中的最小粒子,所以反应中氢原子、氧原子没有发生改变;故填:混合物;氢原子、氧原子.
点评 本题考查了分子的性质以及微观反应示意图的信息,难度不大.

练习册系列答案
相关题目
13.下列说法中不正确的是( )
| A. | 明矾可以净水 | |
| B. | 双氧水制氧气加入二氧化锰后反应速率加快,是由于二氧化锰有催化作用 | |
| C. | 沾满油污的餐具用洗涤剂清洗,是利用洗涤剂的乳化功能 | |
| D. | 饱和溶液的溶质质量分数一定比不饱和溶液的溶质质量分数大 |
14.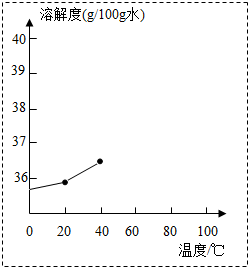 氯化钠与硝酸钾的部分溶解度如表(单位:g/100g水).
氯化钠与硝酸钾的部分溶解度如表(单位:g/100g水).
①请你根据表格中的数据,将氯化钠的溶解度曲线补充完成.(在虚线框内作图)
②在20℃时,将50克硝酸钾溶解在100克水中,形成的是饱和(填“饱和”或“不饱和”)溶液,若升温至40℃,则烧杯中溶液的溶质质量分数为33.3%(精确到0.1%).
③某温度时,氯化钠与硝酸钾的溶解度相等均为S g/100g水,则S的最小范围是36.0<S<36.6.
④在固体硝酸钾中混有少量氯化钠可以通过溶解,蒸发浓缩,降温结晶,过滤等步骤分离提纯硝酸钾.可以利用该方法分离的理由是A、B.
A.固体混合物中硝酸钾的含量较高,氯化钠的含量较低.
B.硝酸钾的溶解度受温度影响变化较大.
C.40℃至100℃,硝酸钾的溶解度始终大于氯化钠.
 氯化钠与硝酸钾的部分溶解度如表(单位:g/100g水).
氯化钠与硝酸钾的部分溶解度如表(单位:g/100g水).| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |

②在20℃时,将50克硝酸钾溶解在100克水中,形成的是饱和(填“饱和”或“不饱和”)溶液,若升温至40℃,则烧杯中溶液的溶质质量分数为33.3%(精确到0.1%).
③某温度时,氯化钠与硝酸钾的溶解度相等均为S g/100g水,则S的最小范围是36.0<S<36.6.
④在固体硝酸钾中混有少量氯化钠可以通过溶解,蒸发浓缩,降温结晶,过滤等步骤分离提纯硝酸钾.可以利用该方法分离的理由是A、B.
A.固体混合物中硝酸钾的含量较高,氯化钠的含量较低.
B.硝酸钾的溶解度受温度影响变化较大.
C.40℃至100℃,硝酸钾的溶解度始终大于氯化钠.
11.解决大班额,学校添置了很多运动设施或器材,这些器材中没有用到有机合成材料的是( )
| A. |  篮球 | B. |  塑胶跑道 | C. |  钢制单杠 | D. |  尼龙跳绳 |
18.下列说法不正确的是( )
| A. | 磷烯是与硅一样的半导体,可用于制作太阳能电池 | |
| B. | 原子、原子核、夸克、质子时按空间尺度从大到小排列的 | |
| C. | 电荷磁的性质有许多相似之处,如同种电荷相互排斥,同名磁极相互排斥 | |
| D. | 汉中油菜花节上,游客远远地就能闻到花的香味,说明分子做无规则运动 |
15.下列实验方案或操作,你认为可行的是( )
| A. | 检验某溶液是不是盐酸,加入碳酸钠溶液 | |
| B. | 通过灼烧闻气味的方法区别涤纶和羊毛纤维 | |
| C. | 用pH试纸测定溶液酸碱度的时候,先将试纸用水润湿 | |
| D. | 稀释浓硫酸时,把水沿器壁慢慢注入浓硫酸里,并不断搅拌 |
12.研究性学习小组测定实验室里一瓶久置的NaOH固体是否变质.
【提出问题】NaOH固体是否变质?
【猜想假设】猜想1:没变质,全部是NaOH;
猜想2:全变质,全部是Na2CO3
猜想3:部分变质,既含有NaOH,又含有Na2CO3;
【进行实验】请你与他们一起完成,并回答所给问题.
上述步骤(1)中,滴加过量氯化钙溶液的目的是③使样品中的Na2C03完全反应.
【实验结论】通过实验,说明上述猜想中④猜想3是正确的.
【拓展】要除去氢氧化钠中含有的碳酸钠,所用的方法(用化学方程式表示)⑤Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【反思】通过探究,实验室中的氢氧化钠应⑥密封保存.
【提出问题】NaOH固体是否变质?
【猜想假设】猜想1:没变质,全部是NaOH;
猜想2:全变质,全部是Na2CO3
猜想3:部分变质,既含有NaOH,又含有Na2CO3;
【进行实验】请你与他们一起完成,并回答所给问题.
| 实验步骤 | 实验现象 | 实验结论 |
| (1)称取上述固体样品8g溶于100mL水配成溶液,向溶液中滴加过量的氯化钙溶液充分反应后,静置. | 产生白色沉淀① | 说明久置固体中,一定含有Na2CO3 |
| (2)用玻璃棒蘸取少量①中的上层清液滴在pH试纸上,与标准比色卡对比,测出pH | pH=10 | 说明固体中,还一定含有 ②NaOH(填化学式). |
【实验结论】通过实验,说明上述猜想中④猜想3是正确的.
【拓展】要除去氢氧化钠中含有的碳酸钠,所用的方法(用化学方程式表示)⑤Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【反思】通过探究,实验室中的氢氧化钠应⑥密封保存.
8.碳铵(碳酸氢铵)是一种速效氮肥,如图1是某袋碳铵标签的一部分,某科学兴趣小组为测定该袋碳铵的纯度,取8.5g样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如表所示

试回答下列问题
(1)你认为在使用碳铵肥料时应注意的问题是储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用.
(2)请在如图2所示的坐标纸上,以反映时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为1.2.
(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果精确到0.1%)
| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | 1.0 | m | 1.5 | 1.6 | 1.7 | 1.7 |

试回答下列问题
(1)你认为在使用碳铵肥料时应注意的问题是储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用.
(2)请在如图2所示的坐标纸上,以反映时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为1.2.
(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果精确到0.1%)
 ”)表示相连物质间可以反应,“→”表示物质间可以转化(注:反应条件、部分反应物或生成物略去).
”)表示相连物质间可以反应,“→”表示物质间可以转化(注:反应条件、部分反应物或生成物略去). ,甲、乙、丙为不同类别的化合物,甲→乙、乙→丙均为复分解反应,则甲与丙反应的化学方程式为Ca(OH)2 +CO2═CaCO3↓+H2O.
,甲、乙、丙为不同类别的化合物,甲→乙、乙→丙均为复分解反应,则甲与丙反应的化学方程式为Ca(OH)2 +CO2═CaCO3↓+H2O.