题目内容
请你结合下列装置图回答问题:

(1)写出有标号仪器的名称:a________,b________.
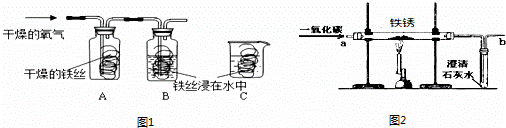
(2)①实验室用甲装置制氧气的化学方程式是________,用________法收集氧气.②试管口放一团棉花的目的是________.③反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是________
黑色粉末在反应中的作用是________.
(3)某同学想用右图装置乙制取CO2,广口瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭的原因是________,为解决这一问题,在不改变原有仪器的基础上添加一种仪器,请把该仪器画在图中应该放置的位置.加了该仪器以后,还有一个好处是________.
(4)某化学兴趣小组用乙装置制取并检验二氧化碳.装置中分液漏斗的作用是可控制________.实验过程中,可观察到试管里产生________色沉淀,证明CO2的生成,该反应的化学方程式是________.若实验过程中一直没有出现证明CO2生成的现象(装置和操作步骤都正确),则可能原因是________.
(5)该小组同学在观察到产生沉淀后继续通入二氧化碳,过了一段时间后,发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
【提出问题】沉淀为什么能溶解变成澄清溶液?
【查阅资料】①碳酸氢钙[Ca(HCO3)2]溶于水;
②碳酸盐溶于酸,Ca(HCO3)2与酸反应跟CaCO3与酸反应类似.
【猜想与假设】①溶液呈酸性; ②反应生成了碳酸氢钙.
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用________蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照. | 测得被测液 的pH=8 | 猜想①________. (填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于 另一支试管中,加入________. | 有气体产生 | 反应的化学方程式为:________ 猜想②成立. |
【交流与反思】从探究中你得到的启示或感受是________.
解:(1)熟悉常见的化学仪器,了解它们的名称.图中a是酒精灯,b是锥形瓶.故答案为:酒精灯;锥形瓶;
(2)①甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气.反应方程式是:2KMnO4 K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不易溶于水,我们可用排水集气法(或向上排空气法)收集;②试管口放一团棉花是防止高锰酸钾粉末随氧气流进入导气管,堵塞导气管;
K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不易溶于水,我们可用排水集气法(或向上排空气法)收集;②试管口放一团棉花是防止高锰酸钾粉末随氧气流进入导气管,堵塞导气管;
③加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2 2H2O+O2↑.
2H2O+O2↑.
故答案分别为:2KMnO4 K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2
K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2  2H2O+O2↑、催化作用;
2H2O+O2↑、催化作用;
(3)由于该装置中漏斗与空气通着,气体从漏斗口溢出,而收集不满二氧化碳;所化装置只要切断气体向外溢出的 路径即可;
路径即可;
(4)分液漏斗的作用是可以控制滴加稀盐酸的速度,即控制了反应速度,还可以控制反应的发生和停止;二氧化碳能够使澄清石灰水变浑浊,是二氧化碳与氢氧化钙反应生成碳酸钙和水.(2)澄清石灰水中通入二氧化碳时,可观察到试管里产生 白 色沉淀,反应的化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O,
(5)产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液,因为生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙;
酸碱度测定的方法是:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定被测溶液的pH.根据pH便可判断溶液的酸碱性强弱,由pH=8>7,溶液呈碱性,因此猜想①溶液呈酸性,不成立;
往沉淀溶解变成澄清溶液里加入足量的稀盐酸,碳酸氢钙与盐酸反应生成二氧化碳,气泡冒出,因此猜想②反应生成了碳酸氢钙,成立;
故答案为:白; Ca(OH)2+CO2═CaCO3↓+H2O;科学探究是学习化学的好方法.
分析:(1)熟悉常见的化学仪器,了解它们的名称;
(2)①甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气;然后根据氧气不易溶于水,密度大于空气密度的特点选择收集方法;②试管口放一团棉花的目的,③反应结束后,给冷却的试管加水过滤得到的黑色粉末是二氧化锰,它可以作为催化剂与过氧化氢溶液反应生成氧气;
(3)气体跑出收集不满,考虑本题,想法堵住向外溢出的漏斗口即可
(4)根据二氧化碳的检验方法考虑,分液漏斗的作用能控制反应;.
(5)根据二氧化碳与澄清石灰水反应,使澄清石灰水[主要成分Ca(OH)2]变浑浊的性质判断试管内的现象,并据此写出反应式.二氧化碳的性质及[Ca(HCO3)2]溶于水,和溶液的酸碱度的测定方法进行分析解答本题.
点评:本题考查常见气体的制取与制取装置的选取,以及化学方程式的书写.考查知识点全面,而且是我们的常见问题.通过回答本题熟记了常见仪器的名称,控制反应的发生和停止的实验装置的设计方法,二氧化碳的验证方法.本题考查学生根据实验室制取氧气的反应原理和二氧化碳的性质及[Ca(HCO3)2]溶于水进行分析解题的能力
(2)①甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气.反应方程式是:2KMnO4
 K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不易溶于水,我们可用排水集气法(或向上排空气法)收集;②试管口放一团棉花是防止高锰酸钾粉末随氧气流进入导气管,堵塞导气管;
K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不易溶于水,我们可用排水集气法(或向上排空气法)收集;②试管口放一团棉花是防止高锰酸钾粉末随氧气流进入导气管,堵塞导气管;③加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2
 2H2O+O2↑.
2H2O+O2↑.故答案分别为:2KMnO4
 K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2
K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2  2H2O+O2↑、催化作用;
2H2O+O2↑、催化作用;(3)由于该装置中漏斗与空气通着,气体从漏斗口溢出,而收集不满二氧化碳;所化装置只要切断气体向外溢出的
 路径即可;
路径即可;(4)分液漏斗的作用是可以控制滴加稀盐酸的速度,即控制了反应速度,还可以控制反应的发生和停止;二氧化碳能够使澄清石灰水变浑浊,是二氧化碳与氢氧化钙反应生成碳酸钙和水.(2)澄清石灰水中通入二氧化碳时,可观察到试管里产生 白 色沉淀,反应的化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O,
(5)产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液,因为生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙;
酸碱度测定的方法是:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定被测溶液的pH.根据pH便可判断溶液的酸碱性强弱,由pH=8>7,溶液呈碱性,因此猜想①溶液呈酸性,不成立;
往沉淀溶解变成澄清溶液里加入足量的稀盐酸,碳酸氢钙与盐酸反应生成二氧化碳,气泡冒出,因此猜想②反应生成了碳酸氢钙,成立;
故答案为:白; Ca(OH)2+CO2═CaCO3↓+H2O;科学探究是学习化学的好方法.
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用玻璃棒蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照. | 猜想①不成立. (填“成立”或“不成立”) | |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于 另一支试管中,加入稀盐酸(硫酸). | 2HCl+Ca(HCO3)2═CaCl2+2H2O+2CO2↑(H2SO4+Ca(HCO3)2═CaSO4+2H2O+2CO2↑) |
分析:(1)熟悉常见的化学仪器,了解它们的名称;
(2)①甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气;然后根据氧气不易溶于水,密度大于空气密度的特点选择收集方法;②试管口放一团棉花的目的,③反应结束后,给冷却的试管加水过滤得到的黑色粉末是二氧化锰,它可以作为催化剂与过氧化氢溶液反应生成氧气;
(3)气体跑出收集不满,考虑本题,想法堵住向外溢出的漏斗口即可
(4)根据二氧化碳的检验方法考虑,分液漏斗的作用能控制反应;.
(5)根据二氧化碳与澄清石灰水反应,使澄清石灰水[主要成分Ca(OH)2]变浑浊的性质判断试管内的现象,并据此写出反应式.二氧化碳的性质及[Ca(HCO3)2]溶于水,和溶液的酸碱度的测定方法进行分析解答本题.
点评:本题考查常见气体的制取与制取装置的选取,以及化学方程式的书写.考查知识点全面,而且是我们的常见问题.通过回答本题熟记了常见仪器的名称,控制反应的发生和停止的实验装置的设计方法,二氧化碳的验证方法.本题考查学生根据实验室制取氧气的反应原理和二氧化碳的性质及[Ca(HCO3)2]溶于水进行分析解题的能力

练习册系列答案
相关题目
 “嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列航天技术中的化学短文并回答有关问题.
“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列航天技术中的化学短文并回答有关问题.
 D、原子结构示意图为
D、原子结构示意图为