题目内容
用
16g25%的氢氧化钠溶液,恰好完全中和20g硫酸溶液.求:(1)此硫酸溶液中溶质的质量分数;
(2)生成物的溶液中溶质的质量分数.
答案:
解析:
提示:
解析:
|
解:设参加反应的 H2SO4质量为x,生成的Na2SO4质量为y2NaOH+H2SO4=Na2SO4+2H2O 80 98 142 16g×25% x y
(1)硫酸溶液中溶质的质量分数= (2)硫酸钠溶液中溶质的质量分数= 【过程探究】此题涉及酸碱中和的化学反应,要求的是溶质的质量分数,已知: 溶质的质量分数= 只要找到溶质的质量与溶液的质量,此题就迎刃而解了. (1)中硫酸溶液的质量为已知,只需根据化学方程式求出硫酸溶质的质量,即可迅速达到目的.(2)生成物(Na2SO4)的质量可根据化学方程式计算求出.硫酸钠溶液的质量可根据守恒法计算得出,即:
再依此计算溶质的质量分数. 问题 1 为什么不能用16g NaOH溶液或20g硫酸溶液当已知数进行化学方程式计算?解答:因为 NaOH溶液和硫酸溶液混合时,实质上是两种溶液中的溶质发生化学反应,所以化学方程式所涉及的量,无论已知量还是未知量均为溶质的质量,即纯物质的量,因此计算时不能用溶液的质量作为已知量.问题 2 此题计算生成物溶液的质量都有哪些方法?解答:计算生成物溶液的质量,常用两种方法:其一是守恒法 (前面已介绍);其二是根据:溶液质量=溶质质量+溶剂质量 溶质质量可根据化学方程式计算找到; 溶剂 (水)质量则应包括参加反应的两种溶液中的水.即:NaOH溶液中水的质量,H2SO4溶液中水的质量,以及反应后生成的水的质量之和.NaOH溶液中水的质量=16g×(1-25%)=12g H2SO4溶液中水的质量=20g-4.9g=15.1g 生成水的质量 (根据化学方程式计算)=1.8g生成物 (Na2SO4)溶液质量=7.1g+12g+15.1g+1.8g=36g此题采用这种方法比较繁杂费时,用守恒法比较简便.选择解题方法应因题而 |
提示:
|
本题考查学生化学综合计算的能力,重点考查溶液中溶质的质量分数计算与化学方程式计算综合解题能力. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

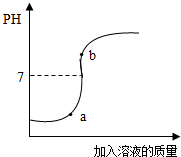 配制4%的氢氧化钠溶液200g,并用此溶液测定某硫酸溶液的溶质质量分数.
配制4%的氢氧化钠溶液200g,并用此溶液测定某硫酸溶液的溶质质量分数.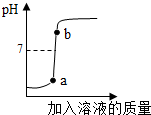 (2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
(2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.