题目内容
某课外活动小组为测定铜铁合金中的铁的质量分数,根据金属活动性强弱不同进行实验来测定.他们取只含铜铁两种金属的合金样品质量20.0g,将80.0g稀硫酸平均分成4份,分4次逐渐加入到样品的烧杯中,每次都充分反应后测得剩余固体质量见表:| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体质量/g | 17.2 | 14.4 | 13.0 | 13.0 |
(2)铜铁合金中,铁元素的质量分数为
分析:铜铁两种金属的合金样品中,只有铁能和稀硫酸反应,铜和稀硫酸不反应.故当向合金样品中加入稀硫酸时,最后剩余固体的质量不再发生变化时,则说明剩余固体是铜,其质量为剩余固体的质量.铜铁合金的质量为20克,又知铜的质量,所以铁的质量分数便不难求出.
解答:解:(1)、通过表中的数据分析可知:第一次加入20克稀硫酸时,固体的质量减少了20-17.2=2.8克.第二次再加入20克稀硫酸时,固体的质量又减少了17.2-14.4=2.8克.第三次再加入20克稀硫酸时,固体的质量却没有减少2.8克,而是减少了14.4-13.0=1.4克,这说明合金样品中铁已经反应完.故第四次再加入20克稀硫酸时,剩余固体的质量不再发生变化.剩余的固体为铜.铜和稀硫酸不发生化学反应,其质量为13.0克.故20.0g 铜铁合金中,铜的质量为 13.0g
(2)、铜铁合金中铁的质量为20-13=7克,故铁元素的质量分数=
×100%=35%
故答案为:(1)13.0g (2)35%.
(2)、铜铁合金中铁的质量为20-13=7克,故铁元素的质量分数=
| 7.0克 |
| 20.0克 |
故答案为:(1)13.0g (2)35%.
点评:本题要求学生会根据表中的数据进行分析,去伪存真,挖掘出有用的数据和知识点.

练习册系列答案
相关题目
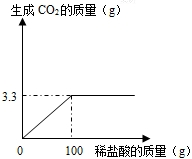 某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制下图.
某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应,也不分解),向其中加入足量的稀盐酸,根据实验测得的数据绘制下图.