题目内容
9.氧气和二氧化碳是两种重要的气体,请根据学过的知识作答:①工业上用分离液态空气的方法制取氧气,主要是利用了氧气和氮气的沸点 不同.二氧化碳的工业制法与实验室制法都选择了大理石,不仅因为这种原料含有碳酸根(填“钙元素”或“碳酸根”),而且来源非常广泛.

②根据图1所给的仪器回答问题
I.写出仪器名称,a铁架台、b锥形瓶;
II.某同学用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节图2中的旋钮②(填“①”或“②”或“③”).
利用改正后的A装置制取氧气,反应的化学方程式:
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,若用装置F收集并粗略测出收集O2体积,还需在m(填m或n)端接一个量筒以便测出排出的水的体积.G图是硫在氧气中燃烧的实验,观察到的现象是产生蓝紫色火焰,有刺激性气味气体产生,该反应的化学方程式是S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
III.实验室也能选用D装置作为氧气发生装置,反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,为了使反应能保持较平稳地进行,应该采取的措施是控制分液漏斗的活塞,使液体缓缓流入锥形瓶;
IV.B、C、D、E均可作为实验室制备CO2的发生装置,E装置制备气体的优点是随开随用,随关随停,若用C装置制备CO2,操作时一定要使长颈漏斗末端插入到液面下,形成液封以免气体从长颈漏斗逸出;若用图3装置排空气法收集CO2,请在图中用箭头画出气体进出的方向
 .
.V.用足量的石灰石和50克稀盐酸充分完全反应,制得二氧化碳为8.8克.试计算:
50克稀盐酸中所含HCl的物质的量(根据化学方程式列式计算);
稀盐酸中HCl的质量分数为29.2%.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.调节图2中的旋钮②,可以在不改变试管倾斜度的情况下降低试管的高度;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可因为试管口没有棉花团,所以不能用加热高锰酸钾的方法;气体一定会在水的上方聚集,所以要在n口进,那么水在m口出;硫在氧气中燃烧的实验,观察到的现象是产生蓝紫色火焰,有刺激性气味气体产生,化学方程式是硫和氧气在点燃的条件下生成二氧化硫.有关化学方程式的计算要准确.
解答 解:①利用氧气跟氮气的沸点不同来分离液态空气,制取二氧化碳需要的是碳酸根与酸的反应;故答案为:沸点 碳酸根
②Ⅰ铁架台是常用的夹持仪器,锥形瓶是常用的反应容器;故答案为:铁架台 锥形瓶
Ⅱ调节图2中的旋钮②,可以在不改变试管倾斜度的情况下降低试管的高度;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可因为试管口没有棉花团,所以不能用加热高锰酸钾的方法;气体一定会在水的上方聚集,所以要在n口进,那么水在m口出;硫在氧气中燃烧的实验,观察到的现象是产生蓝紫色火焰,有刺激性气味气体产生,化学方程式是硫和氧气在点燃的条件下生成二氧化硫;故答案为:②2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ m 产生蓝紫色火焰,有刺激性气味气体产生 S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2
Ⅲ过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;使反应能保持较平稳地进行需要控制分液漏斗的活塞,使液体缓缓流入锥形瓶;故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2 H2O+O2↑ 控制分液漏斗的活塞,使液体缓缓流入锥形瓶
ⅣE装置是启普发生器,其制备气体的优点是随开随用,随关随停;为形成液封以免气体从长颈漏斗逸出,需要让长颈漏斗末端插入到液面以下 CO2密度比空气大,用向上排空气法收集 故答案为:随开随用,随关随停;使长颈漏斗末端插入到液面下 
Ⅴ设所含HCl的物质的量x
n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol
CaCO3+2HCl═CaCl2+CO2↑+H2O
2 1
x 0.2mol
$\frac{2}{1}=\frac{x}{0.2mol}$
x=0.4mol
0.4mol×36.5g/mol÷50×100%=29.2%
故答案为:29.2%
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

| A. | 单质 | B. | 元素 | C. | 分子 | D. | 原子 |
| A. | 分子和原子都可以构成物质 | |
| B. | 保持一氧化碳化学性质的微粒是一氧化碳分子 | |
| C. | 氢气燃烧的过程中,原子重新组合成新的分子 | |
| D. | 分子之间有间隙,原子之间没有间隙 |
| A. | 物质的量的单位是n | |
| B. | 摩尔是国际单位制中七个基本物理量之一 | |
| C. | 1mol二氧化碳分子中含有1mol碳原子和2mol氧原子 | |
| D. | 水的摩尔质量是18g |
| A. | NO2 | B. | CO | C. | SO2 | D. | N2 |
| A. | 10g | B. | 13.4g | C. | 20g | D. | 30g |

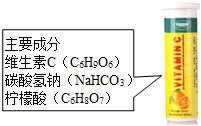 维C泡腾片是一种保健药品,主要成分见如图,将其溶于水会观察到有许多气泡产生.某小组同学对产生的气体进行研究.甲同学认为该气体可能是CO2、O2、CO、H2、N2.乙同学认为不可能是N2,其理由是反应物中不含氮元素,不符合质量守恒定律;丙同学认为不可能是CO或H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒;检验该气体是否为CO2的方法为将气体通入澄清的石灰水中,观察石灰水是否变浑浊.
维C泡腾片是一种保健药品,主要成分见如图,将其溶于水会观察到有许多气泡产生.某小组同学对产生的气体进行研究.甲同学认为该气体可能是CO2、O2、CO、H2、N2.乙同学认为不可能是N2,其理由是反应物中不含氮元素,不符合质量守恒定律;丙同学认为不可能是CO或H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒;检验该气体是否为CO2的方法为将气体通入澄清的石灰水中,观察石灰水是否变浑浊.