题目内容
用相关的化学方程式回答下列问题:
(1)有人误食氯化钡而引起中毒,若及时服用硫酸钠溶液可以解毒,原因是________,若及时服用碳酸钠溶液是否可以解毒________(填“能”或“不能”),原因是________、________.
(2)食盐水中滴加硝酸银溶液,观察到的现象是________,其反应的化学方程式为:________.
解:(1)由于可溶性的氯化钡有毒,误食氯化钡会引起中毒,若及时服用硫酸钠溶液可以解毒,原因是BaCl2+Na2SO3=BaSO4↓+2NaCl;
若服用碳酸钠溶液不能解毒,原因是:BaCl2+Na2CO3=BaCO3↓+2NaCl,BaCO3+2HCl=BaCl2+H2O+CO2↑,由于BaSO4不溶于酸,但BaCO3易溶于酸,胃液呈酸性,含少量HCl,此时BaCO3溶于胃酸,仍能造成人体中毒,Ba2+有剧毒;
(2)食盐水中滴加硝酸银溶液,观察到的现象是产生白色沉淀,其反应的化学方程式为:AgNO3+NaCl=AgCl↓+NaNO3
故答案为:
(1)BaCl2+Na2SO3=BaSO4↓+2NaCl,不能,BaCl2+Na2CO3=BaCO3↓+2NaCl,由于BaSO4不溶于酸,但BaCO3易溶于酸,胃液呈酸性,含少量HCl,此时BaCO3溶于胃酸,仍能造成人体中毒,Ba2+有剧毒.
(2)白色沉淀,AgNO3+NaCl=AgCl↓+NaNO3.
分析:(1)由于可溶性的氯化钡有毒,硫酸钠溶液可和氯化钡反应生成不溶于稀盐酸的硫酸钡沉淀,而碳酸钡与胃液中的盐酸反应生成可溶性的氯化钡,会引起人体中毒,因此不能用碳酸钡代替硫酸钡来解毒.
(2)氯化钠能和硝酸银溶液反应生成白色沉淀硝酸银,根据事实书写反应的化学方程式.
点评:考查盐的化学性质,掌握复分解反应及其发生的条件,正确书写相关的化学方程式.
若服用碳酸钠溶液不能解毒,原因是:BaCl2+Na2CO3=BaCO3↓+2NaCl,BaCO3+2HCl=BaCl2+H2O+CO2↑,由于BaSO4不溶于酸,但BaCO3易溶于酸,胃液呈酸性,含少量HCl,此时BaCO3溶于胃酸,仍能造成人体中毒,Ba2+有剧毒;
(2)食盐水中滴加硝酸银溶液,观察到的现象是产生白色沉淀,其反应的化学方程式为:AgNO3+NaCl=AgCl↓+NaNO3
故答案为:
(1)BaCl2+Na2SO3=BaSO4↓+2NaCl,不能,BaCl2+Na2CO3=BaCO3↓+2NaCl,由于BaSO4不溶于酸,但BaCO3易溶于酸,胃液呈酸性,含少量HCl,此时BaCO3溶于胃酸,仍能造成人体中毒,Ba2+有剧毒.
(2)白色沉淀,AgNO3+NaCl=AgCl↓+NaNO3.
分析:(1)由于可溶性的氯化钡有毒,硫酸钠溶液可和氯化钡反应生成不溶于稀盐酸的硫酸钡沉淀,而碳酸钡与胃液中的盐酸反应生成可溶性的氯化钡,会引起人体中毒,因此不能用碳酸钡代替硫酸钡来解毒.
(2)氯化钠能和硝酸银溶液反应生成白色沉淀硝酸银,根据事实书写反应的化学方程式.
点评:考查盐的化学性质,掌握复分解反应及其发生的条件,正确书写相关的化学方程式.

练习册系列答案
相关题目
氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
实验二:测定所制氮化铝样品中氮化铝的质量分数
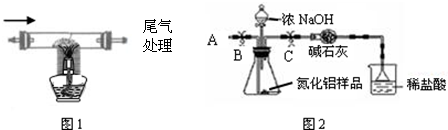
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查 .
(2)装有碱石灰的干燥管作用是 ;装置中使用漏斗的目的是 .
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是 ;图2烧杯中稀盐酸不能换成浓硫酸的理由是 ;图2烧杯中稀盐酸能否换成稀硫酸 .
(4)步骤④的目的是 .
实验结论:所制氮化铝样品中氮化铝的质量分数为 %(写计算过程,4分).
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是: .
拓展探究:(1)实验后剩余的浓NaOH溶液 (能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式 .
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液 g(写计算过程,4分).
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 | ||||
| 1.除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为 2Cu+O2
| ||||
| 2.用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3
|
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查
(2)装有碱石灰的干燥管作用是
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是
(4)步骤④的目的是
实验结论:所制氮化铝样品中氮化铝的质量分数为
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:
拓展探究:(1)实验后剩余的浓NaOH溶液
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液

氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大
型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
实验二:测定所制氮化铝样品中氮化铝的质量分数
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查______.
(2)装有碱石灰的干燥管作用是______;装置中使用漏斗的目的是______.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是______;图2烧杯中稀盐酸不能换成浓硫酸的理由是______;图2烧杯中稀盐酸能否换成稀硫酸______.
(4)步骤④的目的是______.
实验结论:所制氮化铝样品中氮化铝的质量分数为______%(写计算过程,4分).
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:______.
拓展探究:(1)实验后剩余的浓NaOH溶液______(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式______.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液______g(写计算过程,4分).

型集成电路中.在高温下氮气、碳和三氧化二铝反应可以生成氮化铝微晶粉体和一氧化碳,用此方法制得的氮化铝中含有少量杂质碳和氧化铝.某校化学兴趣小组利用上述反应原理制取并测定所得样品中氮化铝的质量分数.
查阅资料:(1)Al2O3+2NaOH=2NaAlO2+H2O; (2)AlN+NaOH+H2O=NaAlO2+NH3↑.氨气易与酸反应.
设计实验:
实验一:制取氮化铝样品
| 实验步骤 | 相关化学反应方程式 |
| 1.除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为 2Cu+O2  2CuO 2CuO |
| 2.用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3  2AlN+3CO 2AlN+3CO |
①按图2组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀盐酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀盐酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀盐酸的烧杯和漏斗的总质量仍为203.4g
实验讨论:(1)步骤①加入样品前还应检查______.
(2)装有碱石灰的干燥管作用是______;装置中使用漏斗的目的是______.
(3)图2烧杯中稀盐酸不能换成浓盐酸的理由是______;图2烧杯中稀盐酸不能换成浓硫酸的理由是______;图2烧杯中稀盐酸能否换成稀硫酸______.
(4)步骤④的目的是______.
实验结论:所制氮化铝样品中氮化铝的质量分数为______%(写计算过程,4分).
事故处理:实验中,小明不小心将盛有约50mL的浓NaOH溶液打翻在桌面上.这时他应该采取的措施是:______.
拓展探究:(1)实验后剩余的浓NaOH溶液______(能或不能)放回原试剂瓶,写出NaOH溶液露置在空气中发生的化学反应方程式______.
(2)本着节约药品的原则,同时又要确保实验顺利获得成功.则实验二中至少应准备40%浓NaOH溶液______g(写计算过程,4分).











