题目内容
(1)利用如图所示装置可测定空气中氧气的含量.

①实验现象,红色物质逐渐变成______.
②反应的化学方程式为______.
③停止加热冷却至室温,注射器内气体的体积大约减少了______.
④实验结论______.
(2)50g溶质质量分数为7.3%的稀盐酸与50g一定溶质质量分数的氢氧化钠溶液恰好完全反应,求反应后所得溶液溶质质量分数.

①实验现象,红色物质逐渐变成______.
②反应的化学方程式为______.
③停止加热冷却至室温,注射器内气体的体积大约减少了______.
④实验结论______.
(2)50g溶质质量分数为7.3%的稀盐酸与50g一定溶质质量分数的氢氧化钠溶液恰好完全反应,求反应后所得溶液溶质质量分数.
(1)在加热热的条件下,铜丝与空气中的氧气反应生成黑色的氧化铜,反应的化学方程式为:2Cu+O2
2CuO;停止加热冷却至室温,注射器内气体的体积大约减少了
,由此可以得出:空气中氧气的体积分数大约为
.
(2)设生成NaCl的质量为x
HCl+NaOH=NaCl+H2O
36.5 58.5
50g×7.3% x
=
x=
=5.85g
反应后所得溶液溶质质量分为
×100%=5.85%
故答为:(1)①黑色 ②2Cu+O2
2CuO ③约
④空气中氧气的体积分数大约为
(2)反应后所得溶液溶质质量分数为5.85%
| ||
| 1 |
| 5 |
| 1 |
| 5 |
(2)设生成NaCl的质量为x
HCl+NaOH=NaCl+H2O
36.5 58.5
50g×7.3% x
| 36.5 |
| 58.5 |
| 50g×7.3% |
| x |
x=
| 58.5×50g×7.3% |
| 36.5 |
反应后所得溶液溶质质量分为
| 5.85g |
| 50g+50g |
故答为:(1)①黑色 ②2Cu+O2
| ||
| 1 |
| 5 |
| 1 |
| 5 |
(2)反应后所得溶液溶质质量分数为5.85%

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
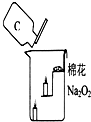 过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包有过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的后熄灭,同时发现棉花燃烧起来.
过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包有过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的后熄灭,同时发现棉花燃烧起来.
 某化学小组同学利用如图所示装置研究可燃物的燃烧条件.
某化学小组同学利用如图所示装置研究可燃物的燃烧条件.


