题目内容
(1)在氧气和二氧化硫的混合气体中,其中氧元素的质量分数为60%,则该混合气体中氧气和二氧化硫的质量比为
(2)一定质量的A溶液和111g氯化钙溶液恰好完全反应,生成白色沉淀B.化学方程式为:A+CaCl2═B↓+2NaCl.
①A的化学式为
②滤出沉淀B,再烘干,称量得10g,则CaCl2溶液中溶质的质量分数为多少?
1:4
1:4
混合气体中二氧化硫的质量分数为80%
80%
.(2)一定质量的A溶液和111g氯化钙溶液恰好完全反应,生成白色沉淀B.化学方程式为:A+CaCl2═B↓+2NaCl.
①A的化学式为
Na2CO3
Na2CO3
.②滤出沉淀B,再烘干,称量得10g,则CaCl2溶液中溶质的质量分数为多少?
10%
10%
.分析:根据题干提供的数据结合质量守恒定律进行分析,氧气和二氧化硫的混合气体中含有氧元素和硫元素,根据已有的化学反应进行解答即可.
解答:解:(1)在氧气和二氧化硫的混合气体中,其中氧元素的质量分数为60%,则硫元素的质量分数为:1-60%=40%,设混合气体的质量为100g,则硫元素的质量为100g×40%=40g,故二氧化硫的质量为:
=80g,故氧气的质量为100g-80g=20g,故氧气和二氧化硫的质量比为:20g:80g=1:4,混合气体中二氧化硫的质量分数为:
×100%=80%,故填:1:4,80%;
(2)①A能与氯化钙反应生成白色沉淀和氯化钠,则A是碳酸钠,B是碳酸钙,故填:Na2CO3;
②设氯化钙的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
x 10g
=
x=11.1g
则CaCl2溶液中溶质的质量分数为:
×100%=10%
故填:10%.
| 40g |
| 50% |
| 80g |
| 100g |
(2)①A能与氯化钙反应生成白色沉淀和氯化钠,则A是碳酸钠,B是碳酸钙,故填:Na2CO3;
②设氯化钙的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
x 10g
| 111 |
| x |
| 100 |
| 10g |
则CaCl2溶液中溶质的质量分数为:
| 11.1g |
| 111g |
故填:10%.
点评:本题考查了根据化学方程式的计算以及根据化学式的计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
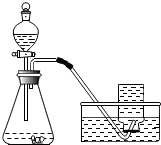 某课外小组研究“影响H2O2 生成O2快慢的因素”的课题.通过查阅资料,他们提出如下猜想.
某课外小组研究“影响H2O2 生成O2快慢的因素”的课题.通过查阅资料,他们提出如下猜想.[提出猜想]催化剂和反应物浓度都会影响H2O2 生成O2的快慢
[实验过程]实验装置图如图所示:
实验操作:检查装置气密性良好.将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体.
实验记录:
| 实验编号 | ① | ② | ③ |
| 反应物 | 5%H2O2100mL | 5%H2O2 | 3%H2O2100mL |
| 加入固体 | 0.5g氯化钠固体 | 0.5g二氧化锰 | |
| 收集气体的时间 | 165s | 46s | 80s |
(2)实验②中加入H2O2的体积为
(3)实验③中加入的固体和用量为
[结论]该探究过程得出的结论是
[反思]H2O2在常温下分解缓慢,加入MnO2后反应明显加快.小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验.该实验选用的药品和用量为
[实验拓展]小红用收集的气体进行氧气的性质实验.
(1)检验氧气的方法是
(2)小红发现用该气体进行氧气的性质实验,现象都不明显.造成这种结果的原因是
 某化学兴趣小组在老师指导下,进行了“H2O2生成O2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)
某化学兴趣小组在老师指导下,进行了“H2O2生成O2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)