题目内容
【题目】往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
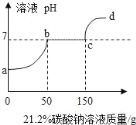
(1)c→d段溶液的pH大于7的原因是_____
(2)c点时溶液中溶质的质量分数是多少?_____(写出计算过程,结果精确到0.1%)
【答案】碳酸钠溶液显碱性 15.6%
【解析】
盐酸与氯化钙的混合溶液中加入碳酸钠溶液,盐酸先与碳酸钠反应,盐酸被消耗,此时溶液pH增大,对应图像中ab段,当盐酸被全部消耗完毕后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,此时溶液为中性,对应bc段,当氯化钙被消耗完毕后,碳酸钠继续加入,溶质变为了碳酸钠和氯化钠,碳酸钠溶液显碱性,所以溶液pH>7,对应图中cd段。
(1)根据分析可知,c→d段溶液中溶质为碳酸钠和氯化钠,碳酸钠溶液显碱性,所以溶液pH>7;
故答案为:碳酸钠溶液显碱性。
(2)盐酸与碳酸钠反应生成了氯化钠、水和二氧化碳,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,因此可以看出到c点时,溶质只有氯化钠,且氯化钠中的钠都来自于碳酸钠,因此根据钠元素质量守恒,所以氯化钠中钠元素质量=碳酸钠中钠元素质量,设氯化钠的质量为m,到c点时加入碳酸钠的溶液质量为150g,含有碳酸钠质量=150g×21.2%=31.8g,
m×氯化钠中钠元素质量分数=碳酸钠质量×碳酸钠中钠元素质量分数
![]()
m=35.1g
盐酸与碳酸钠反应生成了二氧化碳,所以有气体逸出,碳酸钠与氯化钙反应生成了碳酸钙沉淀,此时溶液质量应该减去生成二氧化碳的质量和碳酸钙质量,所以设生成二氧化碳质量为x,生成碳酸钙质量为y,根据题目信息可知,在盐酸与碳酸钠的反应中,消耗碳酸钠消耗质量=50g×21.2%=10.6g,在碳酸钠与氯化钙反应中,消耗的碳酸钠的质量=100g×21.2%=21.2g;

![]()
x=4.4g

![]() ,y=20g
,y=20g
所以在c点时溶液质量=100g+150g-4.4g-20g=225.6g,所以氯化钠形成溶液的溶质质量分数就是氯化钠的质量分数,
氯化钠质量分数= ![]()
故答案为:15.6%。

【题目】某矿石主要成分是 MgO,含少量的 Fe2O3、CuO 和 SiO2 杂质。用该矿石制备 Mg(OH)2 的工艺流程简图如图:

回答下列问题:
(1)步骤①和步骤②均用到的操作是_____________;
(2)步骤①中加过量稀盐酸的目的是______________;
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的 pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的 pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的 pH 范围为________________。