题目内容
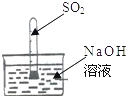
小华同学用如图所示装置进行中和反应实验,反应后为确定硫酸和氢氧化钠是否刚好完全反应,他取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论.
(1)写出该中和反应的化学方程式______.
(2)小亮认为小华的结论不准确,他认为除了“恰好中和”外还有“第二种可能性”,这种可能性是______.
(3)请你另外设计一个实验,验证述烧杯中的溶液是小亮推测的“第二种可能性”
(4)若烧杯中氢氧化钠溶液含溶质0.4克,则需要含溶质多少克的硫酸溶液才能完全中和(根据化学方程式列式计算)?
(1)写出该中和反应的化学方程式______.
(2)小亮认为小华的结论不准确,他认为除了“恰好中和”外还有“第二种可能性”,这种可能性是______.
(3)请你另外设计一个实验,验证述烧杯中的溶液是小亮推测的“第二种可能性”
| 实验操作 | 实验现象 | 实验结论 |
| 取样品,______ | ______ | 确实是小亮推测的“第二种可能性” |

(1)氢氧化钠和硫酸反应生成硫酸钠和水,故答案为:H2SO4+2NaOH=Na2SO4+2H2O;
(2)溶液中性或酸性时,都不会使酚酞变色,恰好完全反应时溶液显中性,硫酸过量时显酸性,故答案为:硫酸过量;
(3)酸会使石蕊变红色.
故答案为:
(4)设中和0.4克的氢氧化钠需要硫酸的质量为为x,
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 0.4g
=
x=0.49g,
故答案为:0.49克.
(2)溶液中性或酸性时,都不会使酚酞变色,恰好完全反应时溶液显中性,硫酸过量时显酸性,故答案为:硫酸过量;
(3)酸会使石蕊变红色.
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| 取 样品,滴加紫色石蕊试液 | 溶液变红 | 确实是小亮推测的“第二种可能性” |
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 0.4g
| 98 |
| x |
| 80 |
| 0.4g |
x=0.49g,
故答案为:0.49克.

练习册系列答案
相关题目
 他的理由是
他的理由是






