题目内容
4.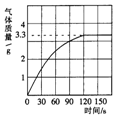 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将90.8克的盐酸加入到12.5g水垢中,完全反应后产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将90.8克的盐酸加入到12.5g水垢中,完全反应后产生CO2气体的情况如图所示.(1)水垢中碳酸钙的质量分数是多少?
(2)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,求完全反应后溶液中MgCl2的质量分数(最后结果保留一位小数).
分析 根据生成的二氧化碳的质量和对应的化学方程式求算碳酸钙的质量,进而求算对应的质量分数.同时根据碳酸钙的质量求算氢氧化镁的质量,结合对应的化学方程式求算氯化镁的质量,进而求算对应的质量分数.
解答 解:由图可知生成的二氧化碳的质量为3.3g.设该石灰石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{44}$=$\frac{x}{3.3g}$
x=7.5g
水垢中碳酸钙的质量分数为$\frac{7.5g}{12.5g}$×100%=60%
氢氧化镁的质量为12.5g-7.5g=5g
设生成的氯化镁的质量为y
Mg(OH)2+2HCl=MgCl2+2H2O
58 95
5g y
$\frac{58}{95}$=$\frac{5g}{y}$
y≈8.2g
完全反应后溶液中MgCl2的质量分数为$\frac{8.2g}{12.5g+90.8g-3.3g}$×100%=8.2%
答:(1)水垢中碳酸钙的质量分数是60%.
(2)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,完全反应后溶液中MgCl2的质量分数为8.2%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
14.下列叙述正确的是( )
| A. | 溶液一定是无色透明的液体 | |
| B. | 溶液的体积等于溶质和溶剂体积之和 | |
| C. | 溶液是均一、稳定的混合物 | |
| D. | 溶质只能是固体或气体 |
15.20℃时,氯化钠的溶解度为36g.对这句话理解正确的是( )
| A. | 20℃时,100g水中能溶解氯化钠36g,形成136克氯化钠的饱和溶液 | |
| B. | 20℃时,100g氯化钠饱和溶液中含氯化钠36g | |
| C. | 20℃时,氯化钠饱和溶液中水与氯化钠的质量比为64:36 | |
| D. | 20℃时,将36g氯化钠溶解于64g水中,所得溶液为该温度下氯化钠的饱和溶液 |
12.现实生活中,氨气多用作致冷剂及农用化肥,其实它还是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气.最近,科学家用一种含钼的化合物作催化剂,在常温下就能完成氨的合成,从而大大降低了生产成本,使得液氨有望取代液氢成为新一代绿色能源.
(1)N2+3H2$\frac{\underline{\;催化剂\;}}{\;}$2NH3,该反应属于基本反应类型中的化合反应.
(2)写出氨气在氧气中燃烧的化学方程式4NH3+3O$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
(3)请你根据下表信息分析用NH3取代H2的优点:
①由于NH3比H2沸点高,所以更易液化,便于储存和运输.
②NH3泄漏时易发现是因为有刺激性气味,一旦泄漏,可用水雾冲洗处理.
(1)N2+3H2$\frac{\underline{\;催化剂\;}}{\;}$2NH3,该反应属于基本反应类型中的化合反应.
(2)写出氨气在氧气中燃烧的化学方程式4NH3+3O$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
(3)请你根据下表信息分析用NH3取代H2的优点:
| 名称 | 颜色、气味 | 熔点(℃) | 沸点(℃) | 25℃水中溶解度(g/L) | 标况下密度 (g/L) |
| NH3 | 无色、刺激性 | -77.7 | -33 | 456 | 0.6942 |
| H2 | 无色、无味 | -259.2 | -253 | 0.0015 | 0.0899 |
②NH3泄漏时易发现是因为有刺激性气味,一旦泄漏,可用水雾冲洗处理.
19.用如图装置电解水,一段时间后的现象如图所示.对该实验的描述错误的是( )


| A. | a试管中收集到的是一种可燃性气体 | |
| B. | 该实验能证明水是由氢元素和氧元素组成 | |
| C. | b试管中收集到的是氧气 | |
| D. | a、b两试管内收集到的气体的质量比约为2:1 |
16.已知SO2与 CO2有许多化学性质是相似的,亚硫酸钙(CaSO3)是白色难溶于水但可溶于酸的固体.某同学向一酸雨样品中滴加 CaCl2,溶液本观察到有浑浊现象,继续滴入NaOH溶液后即有白色沉淀产生.在以上实验过程中,下列不可能发生的化学反应是( )
| A. | SO2+CaCl2+H2O═CaSO3↓十2HCl | B. | SO2+2NaOH═Na2SO3+H2O | ||
| C. | Na2SO3+CaCl2=CaSO3↓+2NaCl | D. | H2SO3+2NaOH=Na2SO3+2H2O |
14.下列物质中,可以和海水、雪碧汽水、酒精溶液归为同一类的是( )
| A. | 冰水 | B. | 泥水 | C. | 碘酒 | D. | 牛奶 |
 如表中1、2、3各项之间能构成如图包含关系的是( )
如表中1、2、3各项之间能构成如图包含关系的是( )