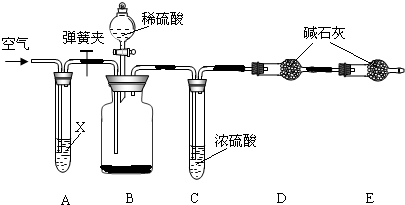
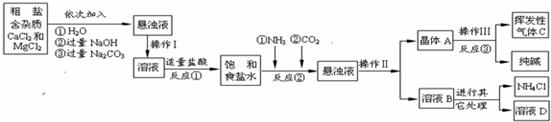
题目内容
“侯氏制碱法”制得的纯碱产品中常含有少量氯化钠,工厂的化验员对每批产品进行检测,标出各种成份后才能投放市场.某厂化验员在实验室中取样品22g,放在烧杯中,加水将其溶解,然后再滴加溶质质量分数为10%的稀盐酸并不断振荡,首先发生反应是:Na2CO3+HCl=NaHCO3+NaCl,后发生反应是NaHCO3+HCl=NaCl+CO2↑+H2O.
在上述过程中,烧杯中溶液质量与加入稀盐酸的质量如下表所示:

请你根据图表中提供的信息,回答下列问题:
(1)加入
(2)在右图中标出产生二氧化碳质量随滴加盐酸质量的变化曲线.(要注明二氧化碳、盐酸的质量)
(3)计算出22g样品中各成分的质量.
在上述过程中,烧杯中溶液质量与加入稀盐酸的质量如下表所示:

| 加入稀盐酸质量/g | 0 | 73 | 74 | 146 | 147 |
| 烧杯中溶液质量/g | 100 | 173 | 173.88 | 237.2 | 238.2 |
(1)加入
73
73
g稀盐酸开始产生二氧化碳,最多产生二氧化碳8.8
8.8
g.(2)在右图中标出产生二氧化碳质量随滴加盐酸质量的变化曲线.(要注明二氧化碳、盐酸的质量)

(3)计算出22g样品中各成分的质量.
分析:根据题给的信息结合所发生的化学反应可以知道:碳酸钠和盐酸反应生成碳酸氢钠消耗了盐酸的质量为73g,而碳酸氢钠和盐酸反应又消耗了73g盐酸,所以可以根据此来完成该题的解答.
解答:解:(1)根据溶液和稀盐酸的质量曲线及表中数据可以知道碳酸钠和盐酸反应生成碳酸氢钠所消耗的盐酸的质量为73g,而至完全反应消耗的盐酸的质量为146g,而起始溶液的质量为100g,故生成二氧化碳的其他的质量为:100g+146g-237.2g=8.8g;
(2)根据(1)的解答可以完成“产生二氧化碳质量随滴加盐酸质量的变化曲线”;
(3)根据题意可以知道生成二氧化碳的质量为8.8g,故可以根据二氧化碳的质量来求算出碳酸钠的质量,进而求算出氯化钠的质量;
设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 8.8g
=
解得:x=21.2g
故氯化钠的质量为:22g-21.2g=0.8g
答:(3)计算出22g样品中碳酸钠的质量为21.2g,而氯化钠的质量为0.8g.
故答案为:(1)73;8.8;
(2)

(3)氯化钠的质量为:0.8g;碳酸钠的质量为21.2g.
(2)根据(1)的解答可以完成“产生二氧化碳质量随滴加盐酸质量的变化曲线”;

(3)根据题意可以知道生成二氧化碳的质量为8.8g,故可以根据二氧化碳的质量来求算出碳酸钠的质量,进而求算出氯化钠的质量;
设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 8.8g
| 106 |
| 44 |
| x |
| 8.8g |
解得:x=21.2g
故氯化钠的质量为:22g-21.2g=0.8g
答:(3)计算出22g样品中碳酸钠的质量为21.2g,而氯化钠的质量为0.8g.
故答案为:(1)73;8.8;
(2)

(3)氯化钠的质量为:0.8g;碳酸钠的质量为21.2g.
点评:本题考查了碳酸钠的性质以及有关的计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
相关题目