题目内容
9.某城市有甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子):H+、Ba2+、Na+、OH-、CO32-、NO3-.两厂单独排放都会造成严重的水污染,若将两厂的污水按一定比例混合,便会变成无色澄清只含硝酸钠的溶液.关于污染源的分析,你认为正确的是BA.CO32- 和NO3-来自同一工厂 B.OH-和NO3-一定不在同一工厂
C.H+和Ba2+一定不在同一工厂 D.Ba2+、CO32-一定不在同一工厂(合理即可).
分析 根据钡离子和碳酸根离子会生成沉淀,氢离子和氢氧根离子能结合成水,氢离子与碳酸根离子能结合成水和二氧化碳,所有的钠、硝酸根离子形成的化合物都易溶于水,溶液中必须存在阴阳离子进行分析.
解答 解:因为OH-、H+不能共存,则若H+在甲厂污水中,则OH-应该在乙厂;H+不能和CO32-共存,则CO32-应该在乙厂;CO32-不能与Ba2+共存,则Ba2+存在于甲厂污水中,溶液中必须同时存在阴阳离子,故甲厂污水中含有NO3-;乙厂污水中含有Na+;即H+、Ba2+、NO3-应该在一个厂;OH-、CO32-、Na+应该在一个厂,因此:
A、CO32- 和NO3-一定不在同一工厂,故A错误;
B、OH-和NO3-一定不在同一工厂,故B正确;
C、H+和Ba2+一定在同一工厂,故C错误;
D、Ba2+、CO32-一定不在同一工厂(合理即可).
故答案为:B;Ba2+、CO32-一定不在同一工厂(合理即可).
点评 本题考查了离子共存的问题,在解此类题时,首先分析选项中离子的性质,只要会生成沉淀、气体、水中的一种,就不能共存.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
20.春天来了,云龙湖景区十里杏花竞相开放,迎春花的映衬使风景格外优美,因此吸引了众多游人.下列有关说法错误的是( )
| A. | 园林养护使用喷灌、滴灌,可以节约用水 | |
| B. | 游人照相时,相机电池的电能变为化学能 | |
| C. | 杏花和迎春花香味不同,因为分子不同,性质不同 | |
| D. | 花草树木的光合作用,是地球碳氧循环的重要媒介 |
17.下列实验操作中,不能达到实验目的是( )
| 选项 | 物质 | 实验目的 | 主要实验操作 |
| A | NaCl(杂质Na2CO3) | 除杂 | 加入适量稀硫酸,充分反应后,蒸发 |
| B | MnO2、KCl | 分离 | 溶解、过滤、洗涤干燥;蒸发结晶 |
| C | NH3(H2O) | 干燥 | 将气体通过装有浓硫酸的干燥装置 |
| D | NaOH、Ca(OH)2 | 鉴别 | 分别加入Na2CO3溶液,观察溶液的变化 |
| A. | A | B. | B | C. | C | D. | D |
14.为了验证黄铜样品(Cu、Zn合金)中,铜的质量分数,小浩同学做了如下试验,往93.7g一定质量分数的稀硫酸溶液中,加入10g样品,并按时称量剩余固体的质量如表:
(1)合金中铜的质量分数是35%;
(2)反应后溶液中溶质质量分数是多少?
(3)往溶液中加入合金样品时,剩余固体的质量为什么开始减少较快,而后逐渐减少较慢因为金属与酸反应的速率与酸的溶度有关,刚开始有与酸的浓度较大,所以反应速率较快,后来随着酸的消耗浓度减小,而反应速率也减小.
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 剩余固体质量 (g) | 6.75 | 5 | 4 | 3.5 | 3.5 |
(2)反应后溶液中溶质质量分数是多少?
(3)往溶液中加入合金样品时,剩余固体的质量为什么开始减少较快,而后逐渐减少较慢因为金属与酸反应的速率与酸的溶度有关,刚开始有与酸的浓度较大,所以反应速率较快,后来随着酸的消耗浓度减小,而反应速率也减小.
1.如图四个图象能正确反映对应变化关系的是( )
| A. |  加热一定质量的高锰酸钾 | B. |  将镁片放入硝酸铜溶液中 | ||
| C. |  木炭在密闭的容器内燃烧 | D. |  电解水生成两种气体 |
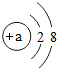 原子得到或失去电子后形成离子,某粒子的结构示意图如图所示.
原子得到或失去电子后形成离子,某粒子的结构示意图如图所示.