题目内容
12.由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题.某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量.
(1)仪器E中的现象澄清的石灰水变浑浊.仪器E中所发生的反应化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
(2)仪器B的作用是吸收水蒸气,干燥从A发生装置中出来的氧气.
(3)若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重b g,则Wg该塑料试样中含氢元素的质量为$\frac{1}{9}$ag(计算结果可为分数形式)
(4)若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果偏大(填“偏小”、“偏大”、“无影响”中之一).
(5)碱石灰的成分是氢氧化钠和氧化钙,则装置连接正确时G装置的作用是防止空气中的CO2进入吸收装置.
分析 (1)依据二氧化碳与石灰水反应原理书写方程式;
(2)根据浓硫酸的吸水性分析;
(3)根据质量守恒定律可知:反应前后元素的质量不变,结合物质中元素的质量分数求解;
(4)根据各装置的用途分析可能的测量结果;
(5)根据空气中的成分可能对测定产生影响分析.
解答 解:
(1)装置E中装的是澄清的石灰水,二氧化碳能使澄清的石灰水变浑浊,反应的原理是二氧化碳和氢氧化钙反应生成水和碳酸钙沉淀,据此书写化学反应方程式;
故为:澄清的石灰水变浑浊; CO2+Ca(OH)2═CaCO3↓+H2O;
(2)装置B中装的是浓硫酸,浓硫酸用于除水蒸气;
(3)塑料试样充分燃烧后,若装置D增重a g,浓硫酸吸水故D增重的质量即W g该塑料试样燃烧生成的水的质量,据质量守恒定律,水中氢元素即塑料样品中的氢元素,所以W g该塑料试样中含氢元素的质量为ag;装置E增重的质量即生成的二氧化碳的质量,样品中的碳元素质量等于生成的二氧化碳中碳的质量,故W g该塑料试样中含氢元素的质量为$\frac{1}{9}$ag,
(4)若装置中没有连接仪器B,从而使实验测得D中的水的质量大于塑料样品燃烧生成的水,故将使该塑料试样中氢元素的质量测算结果偏大.
(5)为防止空气中的CO2从右侧进入氢氧化钙溶液,造成实验误差大,故右侧用F装置来吸收空气中的CO2.
故答案为:
(1)澄清的石灰水变浑浊; CO2+Ca(OH)2═CaCO3↓+H2O;
(2)吸收水蒸气,干燥从A发生装置中出来的氧气.
(3)$\frac{1}{9}$a;
(4)偏大;
(5)防止空气中的CO2进入吸收装置.
点评 本题是实验探究题,考查了化合物中碳元素和氢元素的验证过程和根据化学式的计算,综合性极强,只要看清反应的实质较易解答该题.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
3.下列是某反应的微观示意图,下列说法不正确的是( )


| A. | 化学 变化的实质是分子分裂成原子,原子重新组合成新分子 | |
| B. | 参加反应的 和生成的 和生成的 质量比为7:11 质量比为7:11 | |
| C. | 该反应不属于基本反应类型 | |
| D. | 该反应过程中分子的个数不变 |
20.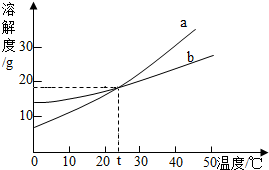 如图是a、b两种固体物质的溶解度曲线.从图中可获得的信息是( )
如图是a、b两种固体物质的溶解度曲线.从图中可获得的信息是( )
 如图是a、b两种固体物质的溶解度曲线.从图中可获得的信息是( )
如图是a、b两种固体物质的溶解度曲线.从图中可获得的信息是( )| A. | 固体物质的溶解度均随温度升高而增大 | |
| B. | a物质的溶解度大于b物质的溶解度 | |
| C. | 降低温度,可使a或b的饱和溶液变为不饱和 | |
| D. | t℃,将相等质量的a、b分别加入100g水中,所得溶液的质量分数一定相等 |
7.下表为各物质所含的少量杂质以及除去这些杂质应选用的试剂或操作方法.正确的一组为( )
| 序号 | 物 质 | 杂 质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3 溶液 | KOH | 加入适量FeCl3溶液,充分反应后过滤. |
| ② | FeSO4 溶液 | CuSO4、H2SO4 | 加入过量铁粉,充分反应后过滤. |
| ③ | CO2 | HCl、H2O | 依次通过盛有NaOH 溶液和浓硫酸的洗气瓶. |
| ④ | CaO 固体 | CaCO3 | 高温煅烧 |
| A. | ①②③④ | B. | ②④ | C. | ③④ | D. | ②③④ |
17.将一杯稀硫酸分成质量相等的四份,然后向这四份硫酸中分别加入足量的下列物质.经过充分反应,除了未反应的固体外,都有硫酸锌溶液.所得溶液中硫酸锌质量分数最大的是加入( )
| A. | Zn | B. | ZnO | C. | Zn(OH)2 | D. | ZnCO3 |
4. 某同学用空塑料饮料瓶做简易净水器,设计图如图.为了获得较好的净水效果,请你帮他继续设计:小卵石、活性炭、石英沙应放在的位置是( )
某同学用空塑料饮料瓶做简易净水器,设计图如图.为了获得较好的净水效果,请你帮他继续设计:小卵石、活性炭、石英沙应放在的位置是( )
 某同学用空塑料饮料瓶做简易净水器,设计图如图.为了获得较好的净水效果,请你帮他继续设计:小卵石、活性炭、石英沙应放在的位置是( )
某同学用空塑料饮料瓶做简易净水器,设计图如图.为了获得较好的净水效果,请你帮他继续设计:小卵石、活性炭、石英沙应放在的位置是( )| A. | ①小卵石、②活性炭、③石英沙 | B. | ①活性炭、②小卵石、③石英沙 | ||
| C. | ①小卵石、②石英沙、③活性炭 | D. | ①活性炭、②石英沙、③小卵石 |
 某同学欲通过“稀盐酸与碳酸钙反应”来证明“质量守恒定律”,设计的实验装置如图所示.
某同学欲通过“稀盐酸与碳酸钙反应”来证明“质量守恒定律”,设计的实验装置如图所示.



 同学们以盖房子的方式总结出了如下物质间的关系.A、B、C均为纯净物,且上、下相邻的物质间均可发生反应.回答下列问题.
同学们以盖房子的方式总结出了如下物质间的关系.A、B、C均为纯净物,且上、下相邻的物质间均可发生反应.回答下列问题.