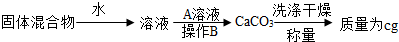题目内容
| |||||||||||||||
答案:
解析:
解析:
(1) |
甲 乙 丁 |
(2) |
(1)NaOH+HCl ==NaCl+H2O,Na2CO3 +2HCl ==2NaCl +H2O+CO2↑ (2)0.57或57% |
(3) |
(1)BaCl2或Ba(OH)2,取加入A溶液反应后,上层清液于试管中,加入稀硫酸溶液,如果产生白色沉淀,说明A溶液已经过量。 (2)过滤。烧杯、漏斗、玻璃棒 (3) |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验测知久储的某NaOH固体中含有水的质量分数为3.5%,含Na2CO3的质量分数为6.5%.若取质量为ag的此样品加入到含HCl质量为bg的稀盐酸(过量)中,完全反应后加入含NaOH质量为cg的NaOH溶液,恰好中和残余的盐酸,则所得溶液蒸干时得到晶体质量可能为( )
| A、1.3ag | B、1.6bg | C、1.32ag+1.46cg | D、1.39ag+1.46cg |
 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ,第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是
甲:适量稀盐酸 乙:过量KOH溶液 丙:适量Ba(OH)2溶液 丁:适量CaCl2溶液.
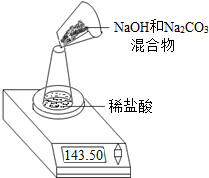
Ⅱ,第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:则混合物中Na2CO3的质量分数为
| 称量项目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 148.30 |

(1)A是
(2)B操作的名称是
(3)混合物中Na2CO3的质量分数为
 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ.第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的
Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中,不合理的是
甲:适量稀盐酸.乙:过量KOH溶液.丙:适量Ba(OH)2溶液.丁:适量CaCl2溶液.
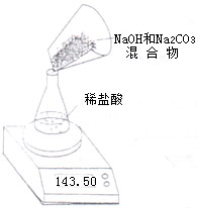
Ⅱ.第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第三次称量的质量 | 148.30 |
(2)混合物中Na2CO3的质量分数为
Ⅲ.第三组选用另一种方案测定NaOH和Na2CO3的混合物(mg)中Na2CO3的质量分数,其操作流程如下:
固体混合物
| 水 |
| ||
| 操作B |
| ||
| 称量 |
(1)A是
(2)B操作的名称是
(3)计算混合物中Na2CO3的质量分数.(写出计算步骤)