题目内容
10.无焰食品加热器常被用于野外加热食物,它所用的材料有镁、铁、氯化钠.使用时加入水,利用镁和水反应产生热来加热.下面是在15℃、标准大气压的环境中对上述材料进行的研究.实验1:将一定质量的镁条、铁粉和氯化钠加入盛有适量水的隔热容器中,连续搅拌,每隔一段时间记录一次温度,在图甲上绘得曲线1:然后把相同质量的镁条剪成若干细条,重复上述实验,绘得曲线2:再取相同质量的镁粉重复上述实验,绘得曲线3.
实验2:把2.4g镁粉、5.85g氯化钠和一定质量的铁粉混合,放入盛有100mL水的隔热容器中,并不断搅拌,一段时间后测出容器内的温度.图乙是在改变铁粉质量的实验条件下,而绘得的温度变化曲线.
实验3:把2.4g镁粉、28g铁粉和一定质量的氯化钠混合,放入盛有100mL水的隔热容器中,并不断搅拌,一段时间后测出容器内的温度.图丙是在改变氯化钠质量的实验条件下,而绘得的温度变化曲线.
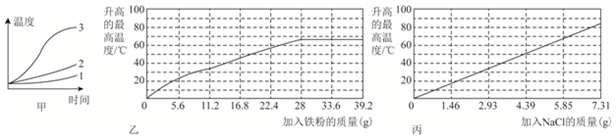
(1)通过实验1可以发现影响镁和水反应快慢的因素是反应物的接触面积.
(2)实验3中,当NaCl质量大于7.31g,实验就不必再做的原因是C.
A.加入更多的NaCl不再改变反应快慢
B.加入NaCl会使反应变慢
C.水已沸腾,不会再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验3中加入了3.65g的NaCl,容器中混合物的温度最接近40-50℃之间.
(4)根据图乙和丙,在设计无焰食物加热器时,如果所用镁粉的质量为2.4g,则取7.31gNaCl和28g铁粉时,能做到用尽可能少的材料产生尽可能多的热量.
分析 根据所给信息和图象正确加以分析和整合;通过图一可知:镁的反应表面积越大反应速度越快,故温度变化较大;图2图象可知:加入氯化钠的质量与升高的最大温度成正比.镁粉比镁条能更快产生热量,在镁和铁质量相等的情况下,7.31g NaCl能使液体达到沸腾.
解答 解:(1))通过图一不难看出镁的反应表面积越大反应速度越快,故温度变化较大;故答案为:反应物的接触面积;
(2)图丙图象可知当氯化钠的量为7.31g时液体沸腾;故答案为;C;
(3)丙图象可知;在实验3中加入了3.65g的NaCl,容器中混合物的温度最接近40-50℃之间,故答案为;40-50℃之间;
(4)镁粉比镁条能更快产生热量,在镁和铁质量和前次实验相等的情况下,7.31g NaCl能使液体达到沸腾,故铁粉的质量为28g,故答案为;28.
点评 本题提供了较多的信息,学生应从较多的信息中寻找解决问题的方法;通过图象可以看出它考查了影响化学反应速率的因素和金属的化学性质.

练习册系列答案
相关题目
17. 地铁是哈尔滨市市民绿色出行的一种方式.哈尔滨市地铁1号线车型确定为B型车,B 型车通常釆用 铝合金和不锈钢车体,车辆内一般不使用木材.下列有关铝合金和不锈钢的说法错误的是( )
地铁是哈尔滨市市民绿色出行的一种方式.哈尔滨市地铁1号线车型确定为B型车,B 型车通常釆用 铝合金和不锈钢车体,车辆内一般不使用木材.下列有关铝合金和不锈钢的说法错误的是( )
 地铁是哈尔滨市市民绿色出行的一种方式.哈尔滨市地铁1号线车型确定为B型车,B 型车通常釆用 铝合金和不锈钢车体,车辆内一般不使用木材.下列有关铝合金和不锈钢的说法错误的是( )
地铁是哈尔滨市市民绿色出行的一种方式.哈尔滨市地铁1号线车型确定为B型车,B 型车通常釆用 铝合金和不锈钢车体,车辆内一般不使用木材.下列有关铝合金和不锈钢的说法错误的是( )| A. | 不锈钢的硬度比铁的硬度大 | |
| B. | 铝合金和不锈钢具有很好的抗腐蚀性能 | |
| C. | 不锈钢和铝合金均属于合成材料 | |
| D. | 不锈钢除含碳外还含有少量的铬和镍 |
1.科学家领导的研究小组成功地制取出盐粒大小的氮5(化学式为N5).在制取氮5的实验中,它曾发生了爆炸,摧毁了实验室的部分设备.因此,科学家们认为,如果能让这种物质保持稳定;则它可能会成为火箭和导弹后级的理想燃燃料.氮5是由排列成V形的5个氮原子结合而成的,化学性质极不稳定.根据以上途述回答下列问题:
(1)比较氮气和氮5的异同点
(2)请你想像一下N5在应用领域有哪些用途?(至少写两条)
(1)比较氮气和氮5的异同点
| 氮气 | 氮5 | ||
不同点 | 分子构成 | ||
| 物理性质 | |||
| 化学性质 | |||
| 相 同 点 | |||
15. 硒被誉为“抗癌大王”,根据如图提供的硒的有关信息,下列说法正确的是( )
硒被誉为“抗癌大王”,根据如图提供的硒的有关信息,下列说法正确的是( )
 硒被誉为“抗癌大王”,根据如图提供的硒的有关信息,下列说法正确的是( )
硒被誉为“抗癌大王”,根据如图提供的硒的有关信息,下列说法正确的是( )| A. | 硒原子有3个电子层 | B. | 硒原子的核电荷数是34 | ||
| C. | 硒的原子结构示意图中x=4 | D. | 硒的相对原子质量是78.96g |
2. 如图是用扫描隧道显微镜获得的苯分子的图象,由此图象可以说明( )
如图是用扫描隧道显微镜获得的苯分子的图象,由此图象可以说明( )
 如图是用扫描隧道显微镜获得的苯分子的图象,由此图象可以说明( )
如图是用扫描隧道显微镜获得的苯分子的图象,由此图象可以说明( )| A. | 分子可分 | B. | 分子质量很小 | C. | 分子在不停运动 | D. | 分子之间有间隔 |

