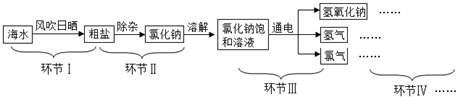
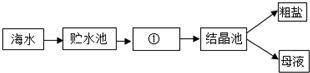
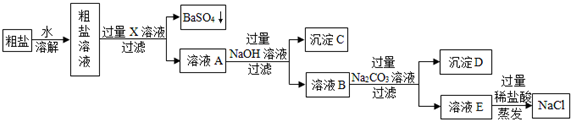
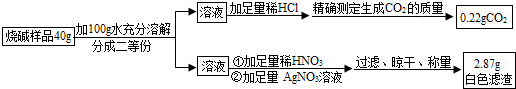
题目内容
12.实验室现有大理石、氯酸钾、二氧化锰、稀盐酸和下列仪器:
(1)若利用上述仪器及药品制取某氧气,所需仪器有①bcdfg(填字母);还需补充的仪器是②水槽;
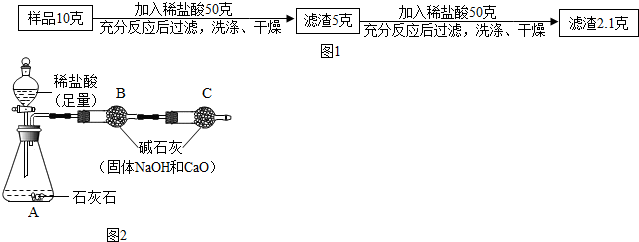
(2)请将甲图中制备二氧化碳的发生装置A补充完整,实验中观察到B中的蜡烛熄灭,原因是①CaCO3+2HCl=CaCl2+CO2↑+H2O(用化学式方程式表示),使锥形瓶内气体②二氧化碳的密度比空气大在压强差作用下,气体进入装置B中,由于二氧化碳③不能燃烧也不支持燃烧使蜡烛与氧气隔绝.
分析 (1)氯酸钾受热时能够分解生成氯化钾和氧气;为了防止高锰酸钾进入导管,通常在试管口塞一团棉花; 氧气的密度比空气的密度大,不易溶于水;
(2)二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取.其反应原理是CaCO3+2HCl=CaCl2+CO2↑+H2O;
解答 解(1)可以利用上述仪器及氯酸钾制取氧气,需要选择的仪器有试管、酒精灯、集气瓶、带导管的单孔橡皮塞、铁架台和水槽;
(2)二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取.其反应原理是CaCO3+2HCl=CaCl2+CO2↑+H2O;反应的装置图如下: ;实验中观察到B中的蜡烛熄灭,原因是反应生成的二氧化碳密度比空气大,在压强差作用下,气体进入装置B中,由于二氧化碳不能燃烧也不支持燃烧使蜡烛与氧气隔绝.
;实验中观察到B中的蜡烛熄灭,原因是反应生成的二氧化碳密度比空气大,在压强差作用下,气体进入装置B中,由于二氧化碳不能燃烧也不支持燃烧使蜡烛与氧气隔绝.
故答案为:(1)bcdfg、水槽;
(2) 、CaCO3+2HCl=CaCl2+CO2↑+H2O、二氧化碳的密度比空气大、不能燃烧也不支持燃烧.
、CaCO3+2HCl=CaCl2+CO2↑+H2O、二氧化碳的密度比空气大、不能燃烧也不支持燃烧.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.根据图示的反应情况,判断下列说法中不正确的是( )

| A. | 部分反应物没有参与反应 | |
| B. | 发生的反应属于复分解反应 | |
| C. | 生成两种产物的质量比为22:7 | |
| D. | 反应过程中参加反应的NO破裂成了原子 |
20.下列叙述,对应的化学方程式,所属基本反应类型都正确的是( )
| A. | 用赤铁矿炼铁:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 还原反应 | |
| B. | 实验室用高锰酸钾制取氧气:2KMnO$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ 分解反应 | |
| C. | 用氢氧化钠溶液吸收三氧化硫 2NaOH+SO3═NaSO4+HO2 复分解反应 | |
| D. | 探究铜和银的活动性Cu+2AgNO3═2Ag+Cu(NO3)2 置换反应 |
7.除去下列物质中的杂质,所选用的试剂和操作方法都正确的是( )
| 编号 | 物质 | 杂质(少量) | 试剂 | 操作方法 |
| A | 氮气 | 氧气 | 铜 | 通过灼热的铜网 |
| B | 氯化亚铁溶液 | 氯化锌 | 足量铁 | 过滤 |
| C | 氯化钾 | 二氧化锰 | 水 | 溶解、过滤、洗涤、干燥 |
| D | 稀硫酸 | 稀盐酸 | 适量硝酸银溶液 | 过滤 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |