题目内容
14.向盛有氢氧化钠溶液的试管中加入1.6g白色的硫酸铜固体粉末,恰好完全反应,过滤,得到溶质质量分数为7.1%的无色溶液20g.(2NaOH+CuSO4═Cu(OH)2↓+Na2SO4)请计算:
(1)所得溶液中溶质的质量是1.42g;
(2)实验前试管中氢氧化钠溶液的质量?
分析 氢氧化钠溶液与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,由生成硫酸钠溶液的质量、溶质的质量分数,由反应的化学方程式列式计算出参加反应的氢氧化钠的质量、生成氢氧化铜沉淀的质量,进而计算出实验前试管中氢氧化钠溶液的质量即可.
解答 解:(1)所得溶液中溶质的质量是20g×7.1%=1.42g.
(2)设实验前试管中氢氧化钠的质量为x,生成氢氧化铜沉淀的质量为y,
2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
80 98 142
x y 1.42g
$\frac{80}{142}=\frac{x}{1.42g}$ x=0.8g
$\frac{98}{142}=\frac{y}{1.42g}$ y=0.98g
实验前试管中氢氧化钠溶液的质量为0.98g+20g-1.6g=19.38g.
答:(1)1.42g;(2)实验前试管中氢氧化钠溶液的质量为19.38g.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列四组溶液不另加试剂就能鉴别的是( )
| A. | BaCl2、NaCl、H2SO4、K2CO3 | B. | Na2SO4、NaCl、Ba(OH)2、KNO3 | ||
| C. | NaOH、K2SO4、NaCl、Ba(NO3)2 | D. | Ba(NO3)2、NaCl、Ca(OH)2、Na2CO3 |
19.下列对宏观现象的微观解释错误的是( )
| A. | CO与CO2化学性质不同,是因为它们的分子构成不同 | |
| B. | NaOH溶液与KOH溶液都能使酚酞溶液变成红色,是因为它们的溶液中都含有OH- | |
| C. | 金刚石和石墨物理性质存在差异,是因为构成它们的碳原子不同 | |
| D. | 温度计受热时,水银柱上升,是因为受热时汞原子间间隔变大 |
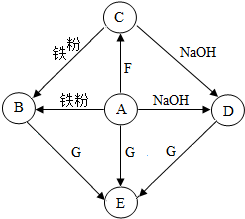 A-G是初中化学常见物质,其中,A的浓溶液能挥发处刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为白色沉淀,如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.
A-G是初中化学常见物质,其中,A的浓溶液能挥发处刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为白色沉淀,如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.
 A~G都是初中化学中常见的物质,已知B为黑色固体,C为胃酸主要成分,F和G为植物光合作用的原料.A、B、C、D、E分别为五种不同类别的物质,它们的转化关系如图所表(“一”表示相互能反应,“一”表示有转化关系).请回答:
A~G都是初中化学中常见的物质,已知B为黑色固体,C为胃酸主要成分,F和G为植物光合作用的原料.A、B、C、D、E分别为五种不同类别的物质,它们的转化关系如图所表(“一”表示相互能反应,“一”表示有转化关系).请回答: