题目内容
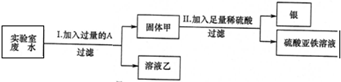
某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:

(1)固体甲中含有的物质是(填化学式)
(2)写出步骤①的化学方程式:
(3)检验步骤①向废水中加入A是否过量的方法是

(1)固体甲中含有的物质是(填化学式)
Ag、Fe
Ag、Fe
;溶液乙的化学式为Zn(NO3)2、Fe(NO3)2
Zn(NO3)2、Fe(NO3)2
.(2)写出步骤①的化学方程式:
Fe+2AgNO3═2Ag+Fe(NO3)2
Fe+2AgNO3═2Ag+Fe(NO3)2
.(3)检验步骤①向废水中加入A是否过量的方法是
取少量固体甲于试管中,加入稀硫酸或稀盐酸,有气泡冒出,则加入的铁过量
取少量固体甲于试管中,加入稀硫酸或稀盐酸,有气泡冒出,则加入的铁过量
.分析:排在氢前面的金属,才能置换出酸中的氢;排在金属活动性顺序中前面的金属一般能把排在后面的金属从其盐溶液里置换出来;
然后结合实验目的分析实验流程图,并根据对流程图的分析,判断流程中所需加入的物质及发生反应的方程式,设计实验检验反应物是否过量.
然后结合实验目的分析实验流程图,并根据对流程图的分析,判断流程中所需加入的物质及发生反应的方程式,设计实验检验反应物是否过量.
解答:解:(1)根据流程可知①中加入的为铁粉,铁能与溶液中的硝酸银反应,得到金属银及过量未完全反应的铁;硝酸银被过量的铁完全反应,锌排在铁的前面,因此溶液中含有不与铁反应的硝酸锌,以及反应后生成和原溶液中就含的硝酸亚铁;
故答案为:Fe、Ag;Zn(NO3)2、Fe(NO3)2;
(2)铁的活动性比银强,加入的铁粉与混合溶液中的硝酸银反应,生成硝酸亚铁和银;
故答案为:Fe+2AgNO3═2Ag+Fe(NO3)2;
(3)加入A过量时,所得固体甲中含有因加入过量而未完全反应的铁,因此可取固体加入稀硫酸或稀盐酸,观察是否有气泡放出,有气泡则固体甲中含铁,加入的铁过量;
故答案为:取少量固体甲于试管中,加入稀硫酸或稀盐酸,有气泡冒出,则加入的铁过量.
故答案为:Fe、Ag;Zn(NO3)2、Fe(NO3)2;
(2)铁的活动性比银强,加入的铁粉与混合溶液中的硝酸银反应,生成硝酸亚铁和银;
故答案为:Fe+2AgNO3═2Ag+Fe(NO3)2;
(3)加入A过量时,所得固体甲中含有因加入过量而未完全反应的铁,因此可取固体加入稀硫酸或稀盐酸,观察是否有气泡放出,有气泡则固体甲中含铁,加入的铁过量;
故答案为:取少量固体甲于试管中,加入稀硫酸或稀盐酸,有气泡冒出,则加入的铁过量.
点评:本题结合实验主要考查了金属活动性顺序表的应用,能培养学生根据所学知识分析、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目