题目内容
12. 化学来源于生活、化学与生活密切相关.
化学来源于生活、化学与生活密切相关.(1)食品包装中充N2以防腐,是由于N2的化学性质稳定.
(2)“合理膳食,均衡营养”会让我们更健康.
①下列食品中富含糖类的是B(填序号,下同).
A.鸡蛋 B.馒头 C.蔬菜
②为了预防佝偻病,幼儿及青少年可以补充一些含钙元素的食品.
(3)生活中的下列做法,有利于人体健康的是B.
A.食用霉变的花生 B.倡导不吸烟
C.食用甲醛溶液浸泡的海产品
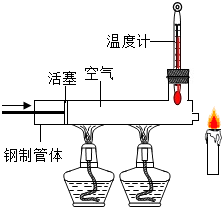
(4)已知石蜡的着火点约为190℃,蜡烛的火焰由气态石蜡燃烧形成,如果所示,在温度计示数为280℃以上时,快速推动活塞,会观察蜡烛立即熄灭.
蜡烛熄灭的主要原因是A(填序号).
A.移动可燃物 B.隔绝氧气 C.降低温度至着火点以下
(5)影视舞台上经常见到云雾缭绕,使人如入仙境的景象,产生这种景象可用的物质是干冰.
分析 (1)根据氮气的化学性质稳定进行分析;
(2)①根据人体所需六大营养素的种类、食物来源,结合题中所给的食物判断所含的营养素,进行分析判断;
②根据钙的生理功能和缺乏症进行分析解答;
(3)根据物质是否对人体具有危害性来分析;
(4)根据灭火的原理进行分析;
(5)根据干冰升华时会吸热进行分析.
解答 解:(1)氮气的化学性质稳定、无毒,因此食品包装中充入氮气用以防腐;
故填:稳定;
(2)①鸡蛋中含有丰富的蛋白质,馒头中富含淀粉,淀粉属于糖类,蔬菜中富含维生素;
故填:B;
②缺钙会得佝偻病,故幼儿及青少年可以补充一些含钙元素的食品;
故填:钙;
(3)食用霉变的花生不正确,因为霉变的花生中有对人体有害的黄曲霉毒素;倡导大家不吸烟是正确的,因为吸烟有害健康;甲醛会使蛋白质发生变性,因此不能食用甲醛溶液浸泡的海产品;
故填:B;
(4)蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成.如图所示,在温度计示数为280℃以上时,快速推动活塞,使气态石蜡被赶走,所以观察到蜡烛立即熄灭,故蜡烛熄灭的主要原因是移走可燃物;
故填:A;
(5)干冰升华时吸收大量的热,使周围空气的温度降低,水蒸汽遇冷凝结成小水滴,因而会看到云雾缭绕的景象;
故填:干冰.
点评 本题体现了化学与社会生活、生产的密切关系,掌握基本的化学知识就能顺利解答.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
2.饮用水的pH在6.5~8.0之间,才符合健康标准.若要使pH低于6.5的天然水达到饮用水的酸碱度范围,下列处理方法最可行的是( )
| A. | 加入适量纯碱 | B. | 加热 | C. | 加入适量食醋 | D. | 加入适量明矾 |
3.下列有关说法不正确的是( )
| A. | 碘、硒等微量元素对人体健康只有微小作用 | |
| B. | 使用化肥和农药是作物增产的重要途径 | |
| C. | 医疗上硫酸钡可用作钡餐透视 | |
| D. | 氯化钠可用作调味品和防腐剂 |
20.煤燃烧产生的废气中含有SO2,SO2是大气污染的主要气体之一,用NaOH、Na2SO3溶液可将90%以上的SO2吸收.涉及的反应有:
①2NaOH+SO2═Na2SO3+H2O
②Na2SO3+SO2+H2O═2NaHSO3
③NaHSO3+NaOH═Na2SO3+H2O
下列说法中,不正确的是( )
①2NaOH+SO2═Na2SO3+H2O
②Na2SO3+SO2+H2O═2NaHSO3
③NaHSO3+NaOH═Na2SO3+H2O
下列说法中,不正确的是( )
| A. | 反应②发生的是化合反应 | |
| B. | 反应③说明NaHSO3属于酸 | |
| C. | Na2SO3中硫元素的化合价是+4 | |
| D. | 反应①说明SO2与CO2有相似的化学性质 |
7.类推是化学学习中常用的思维方法.下列类推正确的是( )
| A. | 活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属 | |
| B. | 酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应 | |
| C. | 单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质 | |
| D. | 碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液 |
4.下列过程是通过物理变化获得能量的是( )
| A. | 风力发电 | B. | 天然气燃烧发电 | ||
| C. | 烧火取暖 | D. | 煤油燃烧推动长征五号火箭升空 |