题目内容
钢铁的生产和使用是人类文明和社会进步的一个重要标志。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是__________
___________________________________________________________________。
 (2)校课外兴趣小组的同学们取潍坊某钢铁厂生铁样品进行实验:将四份不同质量
(2)校课外兴趣小组的同学们取潍坊某钢铁厂生铁样品进行实验:将四份不同质量 的生铁样品(假定其中
的生铁样品(假定其中 只含单质铁和单质碳)分别加到100 g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4 L H2的质量为2 g)
只含单质铁和单质碳)分别加到100 g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4 L H2的质量为2 g)
| 实验序号 | 1 | 2 | 3 | 4 |
| 生铁样品的质量/g | 2.88 | 5.76 | 9.24 | 10.28 |
| 生成H2的体积 (标准状况下)/L | 1.12 | 2.24 | 3.36 | m |
通过计算回答下列问题:
①上述表格中m的值为_______________________________________________。
②根据表中数据计算稀硫酸中H2SO4的质量分数。
【解析】(1)铁生锈是铁与空气中的氧气和水蒸气共同作用的结果。(2)分析表中数据可知,当生铁和硫酸充分反应时每增加2.88 g生铁,就会产生1.12 L氢气,因此当生铁的质量为8.64 g时,就会产生3.36 L氢气,由表中数据可知第三次加入9.24 g生铁,产生了3.36 L氢气,说明此时硫酸已用完,生铁有剩余,因此第四次产生氢气的体积仍为3.36 L,根据100 g稀硫酸最多产生3.36 L氢气,可求出稀硫酸中H2SO4的质量分数。
答 案:(1)铁与空气中的氧气和水蒸气发生反应
案:(1)铁与空气中的氧气和水蒸气发生反应
(2)①3.36
②解:据实验3进行计算
生成H2的质量为: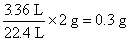
设稀硫酸中H2SO4的质量为x。
Fe + H2SO4====FeSO4 + H2↑
98 2
x 0.3 g
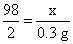
x=14.7 g
稀硫酸中H2SO4的质量分数为:

答:略

 一本好题口算题卡系列答案
一本好题口算题卡系列答案


