题目内容
12. 明明同学用如图装置进行实验,开始时气球沉于烧杯底部,气球内气体Z为单质(气球质量忽略不计).打开分液漏斗活塞后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口.实验过程中没有产生有毒气体.请回答:
明明同学用如图装置进行实验,开始时气球沉于烧杯底部,气球内气体Z为单质(气球质量忽略不计).打开分液漏斗活塞后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口.实验过程中没有产生有毒气体.请回答:(1)写出制取Z的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)写出X与Y反应的化学方程式2HCl+CaCO3═CaCl2+H2O+CO2↑.
分析 根据图示结合已有的知识进行分析解答,气球从烧杯底部慢慢浮起,说明产生的气体的密度大于气球内气体的密度,据此解答.
解答 解:气球内的气体是单质,且X和Y产生的气体后气球浮起,说明产生的气体的密度大于气球内气体的密度,故Z可以是氧气,产生的气体可以是二氧化碳,故X是稀盐酸,Y是碳酸钙,
(1)过氧化氢在二氧化锰的催化作用下反应生成水和氧气,
故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)盐酸能与碳酸钙反应生成氯化钙、水和二氧化碳,
故填:2HCl+CaCO3═CaCl2+H2O+CO2↑.
点评 本题为实验性简答题,完成此题,可以依据已有的知识进行结合题干叙述进行,书写反应的化学方程式要注意配平.

练习册系列答案
相关题目
2.下列与铁有关的叙述中错误的是( )
| A. | 生铁的含碳量低于钢 | |
| B. | 为防止钢铁表面生锈,通常要保持其表面的洁净、干燥或涂上保护膜 | |
| C. | 铁跟氧气在点燃的条件下生成黑色的四氧化三铁固体 | |
| D. | 铁与硫酸铜溶液反应,可置换出铜 |
3.下列实验基本操作中,正确的是( )
| A. | 给物质加热时,应把受热物质放在酒精灯的内焰部分 | |
| B. | 给试管里的物质加热时,必须将试管夹从试管的上部往下套夹在试管的中部 | |
| C. | 如果实验时没有说明液体药品的用量,则取用量应不超过试管容积的$\frac{1}{3}$ | |
| D. | 给烧杯里的物质加热时,必须在烧杯底垫上石棉网 |
1.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是三,理由是氢氧化钠与硫酸会反应,不会同时剩余.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中;
②实验方案中也有一个是错误的,错误的原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是三,理由是氢氧化钠与硫酸会反应,不会同时剩余.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 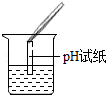 | 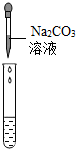 | 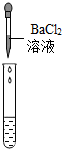 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中;
②实验方案中也有一个是错误的,错误的原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
2.为弄清实验室里一瓶久置的熟石灰是否部分变质,小明进行了实验探究.请帮小明同学完成实验探究报告.
【提出问题】熟石灰样品是否部分变质?
【猜 想】熟石灰样品已部分变质.其依据是CO2+Ca(OH)2═CaCO3↓十H2O (用化学方程式表示):
【实验仪器与药品】胶头滴管、试管、熟石灰样品、水、酚酞试液、稀盐酸.
【探究过程】
【探究结论】小明的猜想不正确 (填“正确”或“不正确”).
【提出问题】熟石灰样品是否部分变质?
【猜 想】熟石灰样品已部分变质.其依据是CO2+Ca(OH)2═CaCO3↓十H2O (用化学方程式表示):
【实验仪器与药品】胶头滴管、试管、熟石灰样品、水、酚酞试液、稀盐酸.
【探究过程】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品加入试管中,加适量的水,振荡,然后滴加酚酞试液 | 溶液变红色 | 样品中存在Ca(OH)2 |
| ②另取少量样品加入另一试管中,然后滴加HCl(或盐酸). | 无气泡产生 | 样品中不存在CaCO3 |
 北京奥运会游泳馆“水立方”内部材料主要由钢铁构成,钢铁属于金属材料(填“金属材料、复合材料”).为确保“水立方”的水质达到国际泳联最新卫生标准,泳池的水将采用“砂滤-臭氧-活性炭”净水工艺,其中活性炭净水是利用它的吸附性.
北京奥运会游泳馆“水立方”内部材料主要由钢铁构成,钢铁属于金属材料(填“金属材料、复合材料”).为确保“水立方”的水质达到国际泳联最新卫生标准,泳池的水将采用“砂滤-臭氧-活性炭”净水工艺,其中活性炭净水是利用它的吸附性.