题目内容
为测定某石灰石样品中CaCO3的质量分数,取该样品6.0g,装入烧杯中,加入36.5g稀盐酸,恰好完全反应(样品中的杂质不溶于水且不与盐酸反应).反应后过滤,得不饱和CaCl2溶液39.3g.(假设操作过程中溶液无损失)试计算:①样品中CaCO3的质量分数. ②稀盐酸中溶质的质量分数.
分析:根据反应后溶液质量的计算方法考虑:反应后溶液质量═参加反应的碳酸钙的质量+稀盐酸质量-生成二氧化碳的质量,设出碳酸钙的质量为X,根据等量关系计算出X的值.
解答:解:(1)设样品中CaCO3质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
x
依题意:x+36.5g=39.3g+
,x=5.0g
CaCO3的质量分数:
×100%=83%
(2)稀盐酸中溶质的质量分数:
×100%=10%
答:样品中CaCO3的质量分数为83%;稀盐酸中溶质的质量分数是10%.
故答案为:①83%;②10%.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
x
| 73x |
| 100 |
| 44x |
| 100 |
依题意:x+36.5g=39.3g+
| 44x |
| 100 |
CaCO3的质量分数:
| 5.0g |
| 6.0g |
(2)稀盐酸中溶质的质量分数:
| 73×5.0g/100 |
| 36.5g |
答:样品中CaCO3的质量分数为83%;稀盐酸中溶质的质量分数是10%.
故答案为:①83%;②10%.
点评:本题容易出错的地方是计算溶液质量时误将杂质算成了溶液质量,不能用6g加盐酸质量减去二氧化碳质量,应该用参加反应的碳酸钙的质量加盐酸质量减去二氧化碳质量.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
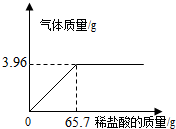 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容: