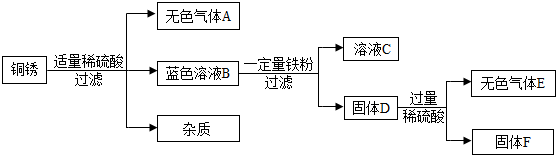
题目内容
用锌片和稀硫酸反应,六次实验结果记录如下(本题结果均取整数).求:(1)二.五两次产生硫酸锌的质量依次是多少.
(2)画出硫酸锌与锌的质量函数关系的曲线.
(3)若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量多少克?
(4)稀硫酸的溶质的质量分数是多少?
| 次数 | 加入锌的质量(g) | 稀硫酸(g) | 生成硫酸锌的质量(g) |
| 一 | 2 | 60 | 5 |
| 二 | 4 | 60 | |
| 三 | 6 | 60 | 15 |
| 四 | 8 | 60 | 17 |
| 五 | 10 | 60 | |
| 六 | 12 | 60 | 17 |
分析:(1)根据生成硫酸锌的质量随加入锌的质量的变化关系得出硫酸锌的质量;
(2)根据实验数据,分析曲线的起点、折点及趋势,绘制出随锌质量增加而生成硫酸锌的质量的关系曲线;
(3)根据表中第四次数据中的硫酸锌质量求出所消耗的锌的质量,然后计算剩余固体质量;
(4)选取硫酸完全反应的第四次实验数据,根据反应的化学方程式,由反应生成的硫酸锌的质量计算出60g硫酸溶液中硫酸的质量,解决硫酸溶液的质量分数.
(2)根据实验数据,分析曲线的起点、折点及趋势,绘制出随锌质量增加而生成硫酸锌的质量的关系曲线;
(3)根据表中第四次数据中的硫酸锌质量求出所消耗的锌的质量,然后计算剩余固体质量;
(4)选取硫酸完全反应的第四次实验数据,根据反应的化学方程式,由反应生成的硫酸锌的质量计算出60g硫酸溶液中硫酸的质量,解决硫酸溶液的质量分数.
解答:解:(1)根据实验数据,锌粒每增加2g,生成的硫酸锌就增加5g,当消耗锌4克时,应生成硫酸锌的质量=
=10g.
(2)设生成17g硫酸锌时,反应掉的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161
x 17g
=
,x≈6.86g
当硫酸反应完全时反应掉的锌的质量为6.86g;金属锌与硫酸接触开始生成硫酸锌,曲线的起点即坐标原点;随锌质量增加生成硫酸锌的质量不断增大,直至锌的质量为6.86g时,恰好完全反应,生成17g硫酸锌,以后反应结束,硫酸消耗完毕,故随锌质量增加而生成硫酸锌的质量不再变化,据此画出曲线;
(3)第4次实验硫酸完全反应,当第5次实验中金属锌的质量增加时,硫酸已消耗完毕,当硫酸反应完全时反应掉的锌的质量为6.86g,多余的锌均剩余,若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量为(10+m)g-6.86g=(m+3.14)g.
(4)设生成17g硫酸锌时消耗硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
98 161
y 17g
=
,y≈10.3g
稀硫酸的溶质的质量分数为:
×100%≈17%
答:稀硫酸的溶质的质量分数为17%.
故答案为:(1)10、17(2)
(3)(m+3.14)g(4)17.2%
| 4g×5g |
| 2g |
(2)设生成17g硫酸锌时,反应掉的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161
x 17g
| 65 |
| x |
| 161 |
| 17g |
当硫酸反应完全时反应掉的锌的质量为6.86g;金属锌与硫酸接触开始生成硫酸锌,曲线的起点即坐标原点;随锌质量增加生成硫酸锌的质量不断增大,直至锌的质量为6.86g时,恰好完全反应,生成17g硫酸锌,以后反应结束,硫酸消耗完毕,故随锌质量增加而生成硫酸锌的质量不再变化,据此画出曲线;
(3)第4次实验硫酸完全反应,当第5次实验中金属锌的质量增加时,硫酸已消耗完毕,当硫酸反应完全时反应掉的锌的质量为6.86g,多余的锌均剩余,若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量为(10+m)g-6.86g=(m+3.14)g.
(4)设生成17g硫酸锌时消耗硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
98 161
y 17g
| 98 |
| y |
| 161 |
| 17g |
稀硫酸的溶质的质量分数为:
| 10.3g |
| 60g |
答:稀硫酸的溶质的质量分数为17%.
故答案为:(1)10、17(2)

(3)(m+3.14)g(4)17.2%
点评:灵活运用数据表中的数据来进行计算,分析表示反应变化特点的曲线时,对于曲线的起点、折点、趋势的分析,可以准确地把握变化的特点.

练习册系列答案
相关题目
用锌片和稀硫酸反应,六次实验结果记录如下(本题结果均取整数).求:
(1)二.五两次产生硫酸锌的质量依次是多少.
(2)画出硫酸锌与锌的质量函数关系的曲线.
(3)若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量多少克?
(4)稀硫酸的溶质的质量分数是多少?
| 次数 | 加入锌的质量(g) | 稀硫酸(g) | 生成硫酸锌的质量(g) |
| 一 | 2 | 60 | 5 |
| 二 | 4 | 60 | |
| 三 | 6 | 60 | 15 |
| 四 | 8 | 60 | 17 |
| 五 | 10 | 60 | |
| 六 | 12 | 60 | 17 |
用锌片和稀硫酸反应,六次实验结果记录如下(本题结果均取整数).求:
(1)二.五两次产生硫酸锌的质量依次是多少.
(2)画出硫酸锌与锌的质量函数关系的曲线.
(3)若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量多少克?
(4)稀硫酸的溶质的质量分数是多少?
(1)二.五两次产生硫酸锌的质量依次是多少.
(2)画出硫酸锌与锌的质量函数关系的曲线.
(3)若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量多少克?
(4)稀硫酸的溶质的质量分数是多少?
| 次数 | 加入锌的质量(g) | 稀硫酸(g) | 生成硫酸锌的质量(g) |
| 一 | 2 | 60 | 5 |
| 二 | 4 | 60 | |
| 三 | 6 | 60 | 15 |
| 四 | 8 | 60 | 17 |
| 五 | 10 | 60 | |
| 六 | 12 | 60 | 17 |