题目内容
将一定质量的锌投入50g稀H2SO4中,恰好完全反应,生成氢气0.2g.求:
(1)实验所需锌的质量?
(2)稀硫酸中溶质的质量分数?
(1)实验所需锌的质量?
(2)稀硫酸中溶质的质量分数?
解;(1)设实验所需锌的质量为x,所需H2SO4的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
∴
=
,
=
,
解之得;x=6.5g,y=9.8g;
(2)稀硫酸中溶质的质量分数为:
×100%=19.6%.
答:(1)实验所需锌的质量为6.5g;(2)稀硫酸中溶质的质量分数为19.6%.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
∴
| 65 |
| 2 |
| x |
| 0.2g |
| 98 |
| 2 |
| y |
| 0.2g |
解之得;x=6.5g,y=9.8g;
(2)稀硫酸中溶质的质量分数为:
| 9.8g |
| 50g |
答:(1)实验所需锌的质量为6.5g;(2)稀硫酸中溶质的质量分数为19.6%.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
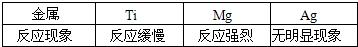
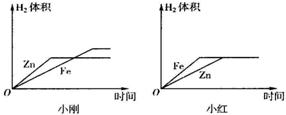
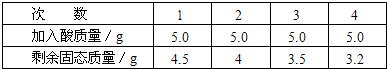
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________

