题目内容
3.海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的化学资源.海水晒盐能够得到粗盐.(1)在粗盐的提纯中,主要操作过程如图所示:

①A、B、C 操作的名称分别叫做溶解、过滤、蒸发.
②上述 A、B、C 操作中,都使用了玻璃棒.B项操作中玻璃棒的作用是引流.
(2)将粗盐提纯可以得到纯净的食盐.小明要用50 g质量分数为10%的食盐溶液来进行种子选种.下图是他配制食盐溶液的实验操作示意图.

指出图中的一处操作错误:食盐和砝码放颠倒了,由此错误可能会造成配制的食盐溶液质量分数偏小.(填“偏大”或“偏小”)
(3)配制好的上述10%的氯化钠溶液50克,欲将其溶质质量分数增加到20%,可以采用的方法是B
①加入5克氯化钠固体 ②把水蒸发掉25克
③加入6.25克氯化钠固体 ④把溶液中的水蒸发掉一半
A.①②B.②③C.③④D.①④
分析 (1)①A、B、C操作的名称分别叫做溶解、过滤、蒸发;
②玻璃棒用途有搅拌、引流、转移物质等;
(2)利用天平称量时,应该是左物右砝;根据实际称量的食盐质量多少分析判断;
(3)根据溶质质量分数的计算公式分析判断.
解答 解:(1)①A、B、C操作的名称分别叫做溶解、过滤、蒸发..
②上述 A、B、C 操作中,都使用了玻璃棒,B项操作中玻璃棒的作用是引流.
(2)图①中的操作错误:食盐和砝码放颠倒了;由此错误可能会造成实际称取的食盐的质量偏小,致使配制的食盐溶液质量分数偏小;
(3)①加入5克氯化钠固体后溶质的质量分数是:$\frac{50g×10%+5g}{50g+5g}×100%$≈18%;
②把水蒸发掉25克后溶质的质量分数是:$\frac{50g×10%}{50g-25g}×100%$=20%
③加入6.25克氯化钠固体后溶质的质量分数是:$\frac{50g×10%+6.25g}{50g+6.25g}×100%$=20%
④把溶液中的水蒸发掉一半后溶质的质量分数是:$\frac{50g×10%}{50g-\frac{1}{2}(50g-50g×10%)}×100%$≈18%
由以上分析可知B正确.
故答为:(1)①过滤;②引流.(2)食盐和砝码放颠倒了,偏小;(3)B.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
15.根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:
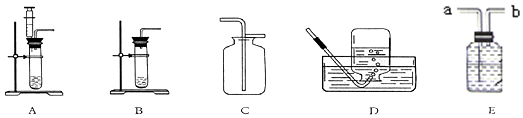
(1)既能用D排水法,又能用C向上排空气法收集的气体是O2.
(2)用如图所示E盛满水的集气瓶收集CH4,气体应从b端进入.
(3)采用A装置制取气体比B装置制取气体,它的优点是可以随时添加液体药品,可以控制反应的速度
| 空气 | NH3 | CH4 | HCl | O2 | |
| 密度/g•L-1 | 1.293 | 0.771 | 0.717 | 1.629 | 1.43 |
| 溶解性 | ---- | 极易溶 | 难溶 | 极易溶 | 难溶 |
(2)用如图所示E盛满水的集气瓶收集CH4,气体应从b端进入.
(3)采用A装置制取气体比B装置制取气体,它的优点是可以随时添加液体药品,可以控制反应的速度

11.下列各项中,括号内物质是除去杂质所用的试剂(适量)或物品,其中错误的是( )
| A. | 氯化亚铁溶液中混有氯化铜(铁粉) | B. | 铜粉中混有铁粉(磁铁) | ||
| C. | O2中混有CO2(NaOH溶液) | D. | CuSO4中混有NaCl(AgNO3溶液) |
8.生命的孕育和维系需要水,科学研究离不开水.请你完成下列探究.
探究一:用水作溶剂.在盛有5ml水和5ml汽油的两只试管中各加入1~2小粒高锰酸钾,可观察到的现象是高锰酸钾溶于水形成紫红色溶液,而高锰酸钾难溶于汽油,结论:同一种物质在不同溶剂中的溶解性不同.
探究二:用水区别物质.自选两种白色固体,用水区别它们,设计实验完成下表内容.
探究三:溶质在水中的溶解与结晶.
【查阅资料】?20℃时,五种物质的溶解度如下表.
?相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变.
【提出问题】20℃时,将11.7gNaCl和15.8gNH4HCO3同时放入盛有100g水的烧杯中,充分搅拌,静置,有晶体析出(温度仍为20℃).析出的晶体是什么?
【设计实验】设计方案,并进行实验.
(1)取少量晶体与熟石灰粉末混合、研磨,无明显现象.实验目的是证明晶体不是氯化铵.
(2)取少量晶体于试管中,加入盐酸,现象为有无色气体产生.
【实验结论】(3)析出的晶体是NaHCO3,晶体的质量为7.2g.
【实验拓展】(4)析出晶体的原因是NaCl和NH4HCO3溶于水未达饱和,所以不能以晶体析出,它们在水中解离出Na+、Cl-、NH4+、HCO3-,阴阳离子运动结合成NaHCO3和NH4Cl,由于NH4Cl溶解度较大,未达饱和,故不能析出,但NaHCO3的溶解度小,且溶液已达饱和,所以过多的NaHCO3以晶体形式析出.
探究一:用水作溶剂.在盛有5ml水和5ml汽油的两只试管中各加入1~2小粒高锰酸钾,可观察到的现象是高锰酸钾溶于水形成紫红色溶液,而高锰酸钾难溶于汽油,结论:同一种物质在不同溶剂中的溶解性不同.
探究二:用水区别物质.自选两种白色固体,用水区别它们,设计实验完成下表内容.
| 两种白色固体 | 主要操作、现象和结论 |
| 碳酸钙、氧化钙 | 分别将两种固体加水溶解,难溶于水的是碳酸钙,与水剧烈反应且有热量放出的是氧化钙 |
【查阅资料】?20℃时,五种物质的溶解度如下表.
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2CO3 |
| 溶解度/g | 36.0 | 21.0 | 37.2 | 9.6 | 21.5 |
【提出问题】20℃时,将11.7gNaCl和15.8gNH4HCO3同时放入盛有100g水的烧杯中,充分搅拌,静置,有晶体析出(温度仍为20℃).析出的晶体是什么?
【设计实验】设计方案,并进行实验.
(1)取少量晶体与熟石灰粉末混合、研磨,无明显现象.实验目的是证明晶体不是氯化铵.
(2)取少量晶体于试管中,加入盐酸,现象为有无色气体产生.
【实验结论】(3)析出的晶体是NaHCO3,晶体的质量为7.2g.
【实验拓展】(4)析出晶体的原因是NaCl和NH4HCO3溶于水未达饱和,所以不能以晶体析出,它们在水中解离出Na+、Cl-、NH4+、HCO3-,阴阳离子运动结合成NaHCO3和NH4Cl,由于NH4Cl溶解度较大,未达饱和,故不能析出,但NaHCO3的溶解度小,且溶液已达饱和,所以过多的NaHCO3以晶体形式析出.
15.隐形眼镜洗液的主要成分是 H2O2(双氧水).下列说法正确的是( )
| A. | H2O2是由氢气和氧气组成的 | |
| B. | H2O2是由氢元素和氧元素组成的 | |
| C. | H2O2是氢分子和氧分子构成的 | |
| D. | H2O2是由两个氢元素和两个氧元素构成的 |
12.2014年3月11日,媒体报道了先枫韵幼儿园给幼儿吃“病毒灵(主要成分为C6H13N5O•HCl)一事.据悉幼儿服用后会出现长期便秘、肚子疼、腿疼、出汗、食欲不振等不良症状.下列有关其主要成分的说法不正确的是( )
| A. | C6H13N5O•HCl完全燃烧后的产物中肯定有二氧化碳 | |
| B. | C6H13N5O•HCl中C、H、O的质量比为36:7:8 | |
| C. | C6H13N5O•HCl属于无机化合物 | |
| D. | 1个C6H13N5O•HCl分子是由6个C原子、14个H原子、5个N原子、1个O原子和1个Cl原子构成 |
13.原子是构成物质的基本粒子,下列有关原子的叙述错误的是( )
| A. | 原子在化学变化中能够再分 | |
| B. | 原子质量主要集中在原子核上 | |
| C. | 原子的质子数等于核外电子数 | |
| D. | 原子的体积及在化学变化中的表现是由电子数决定的 |
 如图是3种不同物质的溶解度曲线图,根据图象回答以下问题:
如图是3种不同物质的溶解度曲线图,根据图象回答以下问题: