题目内容
 为了分析生铁中铁的含量,某学习小组称取5.9g生铁样品,并粉碎,然后往粉末中逐滴加入质量分数为20%的硫酸,反应过程中产生气体的质量与加入硫酸的质量关系如图所示(假设生铁中杂质不与稀硫酸反应,也不溶于水).
为了分析生铁中铁的含量,某学习小组称取5.9g生铁样品,并粉碎,然后往粉末中逐滴加入质量分数为20%的硫酸,反应过程中产生气体的质量与加入硫酸的质量关系如图所示(假设生铁中杂质不与稀硫酸反应,也不溶于水). (1)样品中的铁完全反应时,消耗20%硫酸的质量是
(2)计算生铁样品中铁的质量分数(精确到0.1%);
(3)恰好完全法反应时,所得溶液中溶质的质量分数为多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)从图示可得硫酸的质量;
(2)根据铁与硫酸反应的化学方程式,已知所用硫酸的质量和质量分数,能够计算出生铁中铁的质量分数和氢气的质量;
(3)根据铁与硫酸反应的化学方程式,已知所用硫酸的质量和质量分数,能够计算出所得溶液中溶质的质量,所得溶液的质量为铁的质量与硫酸的质量之和减去氢气的质量.
(2)根据铁与硫酸反应的化学方程式,已知所用硫酸的质量和质量分数,能够计算出生铁中铁的质量分数和氢气的质量;
(3)根据铁与硫酸反应的化学方程式,已知所用硫酸的质量和质量分数,能够计算出所得溶液中溶质的质量,所得溶液的质量为铁的质量与硫酸的质量之和减去氢气的质量.
解答:解:(1)铁完全反应用去硫酸的质量从图示中可以看出是49克;
设生铁样品中铁的质量为x,生成硫酸亚铁的质量为y,生成氢气的质量为z
Fe+H2SO4 =FeSO4 +H2↑
56 98 152 2
x 49g×20% y z
=
=
=
解得:x=5.6g,y=15.2g,z=0.2g
(2)生铁样品中铁的质量分数:
×100%=94.9%;
答:生铁样品中铁的质量分数为94.9%;
(3)反应后所得溶液的质量为:5.6g+49g-0.2g=54.4g
所得溶液中溶质的质量分数为:
×100%=28%
答:所得溶液中溶质的质量分数为28%.
设生铁样品中铁的质量为x,生成硫酸亚铁的质量为y,生成氢气的质量为z
Fe+H2SO4 =FeSO4 +H2↑
56 98 152 2
x 49g×20% y z
| 56 |
| x |
| 98 |
| 49g×20% |
| 152 |
| y |
| 2 |
| z |
解得:x=5.6g,y=15.2g,z=0.2g
(2)生铁样品中铁的质量分数:
| 5.6g |
| 5.9g |
答:生铁样品中铁的质量分数为94.9%;
(3)反应后所得溶液的质量为:5.6g+49g-0.2g=54.4g
所得溶液中溶质的质量分数为:
| 15.2g |
| 54.4g |
答:所得溶液中溶质的质量分数为28%.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列关于盐酸化学性质的有关实验中可观察到明显实验现象的是( )
| A、向盐酸中滴加碳酸钠溶液 |
| B、向盐酸中滴加酚酞溶液 |
| C、向盐酸中滴加氢氧化钠溶液 |
| D、把铜丝放入到盐酸中 |
 碳元素是组成许多物质的基本元素.
碳元素是组成许多物质的基本元素.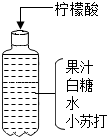 小华按如图配方自制了一瓶清凉甘甜的汽水.根据图中信息回答:
小华按如图配方自制了一瓶清凉甘甜的汽水.根据图中信息回答:

