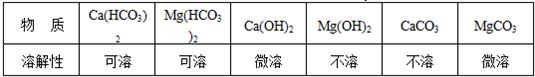
题目内容
24g Mg 和28g Fe分别与过量的盐酸完全反应,则
- A.Mg放出的H2多
- B.Fe放出的H2多
- C.Mg和Fe放出的H2一样多
- D.Mg和Fe放出的H2无法比较
A
分析:金属与足量酸的反应生成氢气的多少,可通过化学反应方程式的有关量的规律得出,让其生成相同的氢气看需要的金属质量的多少完成判断.
解答:由镁、铁与盐酸反应的化学方程式可知,要生成2份质量的氢气,需要镁24份,铁56份,所以24g Mg 和28g Fe分别与过量的盐酸完全反应,产生氢气较多是Mg.
故选A
点评:此题是一道基本计算题,解题的关键是对反应时量的关系的判断.
分析:金属与足量酸的反应生成氢气的多少,可通过化学反应方程式的有关量的规律得出,让其生成相同的氢气看需要的金属质量的多少完成判断.
解答:由镁、铁与盐酸反应的化学方程式可知,要生成2份质量的氢气,需要镁24份,铁56份,所以24g Mg 和28g Fe分别与过量的盐酸完全反应,产生氢气较多是Mg.
故选A
点评:此题是一道基本计算题,解题的关键是对反应时量的关系的判断.

练习册系列答案
相关题目