题目内容
3.欲测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀盐酸和必要的仪器.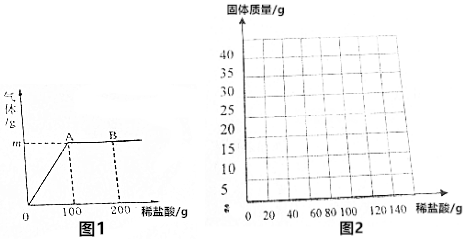
(1)你认为能测出铜的质量分数的是Cu~Zn合金.
(2)取该合金的粉末32.5g于烧杯中,并逐渐滴入稀盐酸,当稀盐酸滴加至100g时,烧杯内剩余物质的总质量为132.1g(产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图1所示,试计算:
①A点产生气体质量m的数值是0.4.
B点时,烧杯内溶液中溶质的化学式:ZnCl2、HCl.
②求该合金中铜的质量分数?(写出计算过程)
③画出Cu-Zn合金质量随加稀盐酸质量变化关系图.
分析 (1)根据在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气分析;加入100克稀盐酸时,反应已经结束.再加入稀盐酸时,反应不再进行.
(2)根据图中信息判断生成氢气的质量,根据化学方程式可以计算锌的质量即可解答.
(3)根据反应结束后加入稀盐酸的质量与剩余的质量关系分析.
解答 解:(1)只给出盐酸和必要的仪器,则合金中需含有能与盐酸反应的金属,锌排在氢的前面,而铜和银排在氢的后面,不与盐酸反应,所以只能测出铜锌合金.
故本题答案为:Cu~Zn;
(2)①点产生气体的质量为:32.5g+100g-132.1g=0.4g.B点时反应结束,这时的溶质是氯化锌,再加入稀盐酸时溶质又多了氯化氢,这时的溶液中含有氯化锌和氯化氢,
故填:0.4.ZnCl2、HCl.
②设生成0.4g氢气需要锌的质量为x,则有
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.4g
$\frac{65}{x}=\frac{2}{0.4g}$
解之得:x=13g;
合金中铜的质量分数为:$\frac{32.5g-13g}{32.5g}×$100%=60%
答:该合金中铜的质量分数为60%.
③合金开始的质量为32.5g,加入稀盐酸后锌与酸反应,使固体质量减少,由(2)计算可知加入100克稀盐酸时,反应已经结束,消耗锌的质量为13g;剩余固体质量为:32.5g-13g=19.5g;故Cu-Zn合金质量随加稀盐酸质量变化关系图为:
答案: .
.
点评 本题是一种综合性的题型,将溶液、化学反应和图象融合在一起,有一定的难度,要求比较高.通常学生在计算时常常会忽视了实际参加反应的是溶液中溶质的质量,而往往会把数据直接代入化学方程式进行计算.这就要求学生足够细心、会分析、且条理分明.

| A. | 它可用作散热材料 | B. | 它的硬度小于金刚石 | ||
| C. | 它可用作新型电池的电极 | D. | 它完全燃烧生成二氧化碳 |
| A. | NiSO4溶液 | B. | CuSO4溶液 | C. | Na2CO3溶液 | D. | AgNO3溶液 |
| A. |  | B. |  | C. |  | D. |  |
 某天然矿泉水中元素及物质含量如下表所示,请用相关化学用语回答下列问题.
某天然矿泉水中元素及物质含量如下表所示,请用相关化学用语回答下列问题. | 矿泉水中主要成分(mg/L) | |
| 偏硅酸(H2SiO3)30-50 硫酸根3-8 氯离子1-5 | 钙7-20 钠3-16 钾2-8 镁6-20 |
(2)标出偏硅酸中硅元素的化合价H2$\stackrel{+4}{Si}$O3;
(3)产自溶洞中的水中含有微量的二氧化碳,保持二氧化碳化学性质的最小粒子是CO2;
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一.请写出Ca(HCO3)2受热分解的化学方式:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+H2O+CO2↑;
(5)有经验的鱼民在进行长途运输鲜鱼的过程中常常在水中加入少量的过氧化钙固体.已知反应的方程式表示为2CaO2+2H2O=2Ca(OH)2+X↑,则X的化学式为O2,请说出使用过氧化钙可以使鱼长期存活的理由:能释放出氧气.
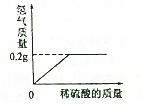 (1)知某化学式为MCO3的相对分子质量为100.
(1)知某化学式为MCO3的相对分子质量为100.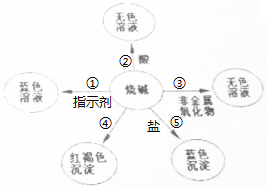 (1)请你在编号①、⑤处各填入一种物质;①是石蕊试液⑤是硫酸铜.
(1)请你在编号①、⑤处各填入一种物质;①是石蕊试液⑤是硫酸铜.