题目内容
19.(1)对于稀H2SO4而言,溶质的质量分数越大,溶液的酸性越强,常温下,10%的稀H2SO4的pH小于(填“大于”“小于”或“等于”)2%的稀H2SO4的pH.(2)如果要使稀H2SO4的pH升高,你采取的方法有:
①不能发生化学反应的方法加入一定量的水;
②有化学反应发生的三种方法(只要求写出所加物质的名称或化学式,且三种物质的类别不同).
分析 根据信息,稀硫酸,浓度越大,酸性越强,也就是pH越小.改变溶液的酸性,就是降低溶液的浓度,一种思路是消耗氢离子从而降低浓度,这需要发生化学变化,即体现酸的通性;二是降低氢离子的浓度,就是让溶液总体积增加,且不引入新的氢离子,物理方法.
解答 解:
(1)硫酸的质量分数越大,pH越小,10%的稀硫酸溶质质量分数大于2%的稀硫酸,故10%的稀硫酸的酸性强于2%的稀硫酸,其pH小;
(2)①要使pH升高,即pH变大,不发生化学变化需要使溶液的溶质质量分数变小,可以采用加水稀释的方法,故填:加入一定量的水;
②选择能消耗硫酸的物质加入,例如,锌、氧化钙、氢氧化钠溶液等,故填:适量的锌、氧化钙、氢氧化钠溶液.
答案:
(1)小于;
(2)
①加入一定量的水;
②适量的锌、氧化钙、氢氧化钠溶液.
点评 本题主要考查了溶液的质量分数大小与溶液pH大小的关系问题,完成此题,可以依据已有的知识结合酸的性质进行.

练习册系列答案
相关题目
14.锰和镍(Ni)都是金属元素,将镍丝插入MnSO4溶液中无变化,插入CuSO4溶液中,镍丝上有红色固体析出,则Mn、Ni、Cu三种金属的活动顺序是( )
| A. | Cu>Ni>Mn | B. | Cu>Mn>Ni | C. | Mn>Ni>Cu | D. | Mn>Cu>Ni |
4.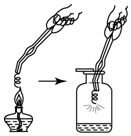 科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:
科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:
(1)甲同学只发现“铁丝”红热一下,就没有观察到其它现象,请你分析铁丝没有燃烧的可能原因是集气瓶中氧气不足(只答一条).
(2)乙同学发现“铁丝”在纯净氧气中燃烧起来,请写出该反应的符号表达式:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;,集气瓶底放水或细沙的原因防止高温生成物炸裂瓶底.
(3)为弄清铁在氧气中燃烧火星四射的原因,小华进行了如下探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径为0.4mm)放入氧气中燃烧时的实验现象的记录.请分析回答:
①你认为表格中未填满的实验现象是剧烈燃烧,大量火星;
②造成铁丝在氧气中燃烧时火星四射的主要原因是碳与氧气或熔融状态的铁的氧化物反应生成二氧化碳气体,二氧化碳气体体积迅速膨胀,推动周围的呈熔融状态的铁及其氧化物向四周飞溅,于是我们便看到火星四射的实验现象.
 科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:
科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:(1)甲同学只发现“铁丝”红热一下,就没有观察到其它现象,请你分析铁丝没有燃烧的可能原因是集气瓶中氧气不足(只答一条).
(2)乙同学发现“铁丝”在纯净氧气中燃烧起来,请写出该反应的符号表达式:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;,集气瓶底放水或细沙的原因防止高温生成物炸裂瓶底.
(3)为弄清铁在氧气中燃烧火星四射的原因,小华进行了如下探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径为0.4mm)放入氧气中燃烧时的实验现象的记录.请分析回答:
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出耀 眼白光,无火星 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 |
②造成铁丝在氧气中燃烧时火星四射的主要原因是碳与氧气或熔融状态的铁的氧化物反应生成二氧化碳气体,二氧化碳气体体积迅速膨胀,推动周围的呈熔融状态的铁及其氧化物向四周飞溅,于是我们便看到火星四射的实验现象.
11.下列不属于氢氧化钠用途的是( )
| A. | 制造肥皂 | B. | 作某些气体的干燥剂 | ||
| C. | 用于造纸和纺织 | D. | 用于治疗胃酸过多 |
8.下列方法中可用来简便区别硬水和软水的是( )
| A. | 观察颜色 | B. | 加热蒸发 | C. | 加入明矾、搅拌 | D. | 加入肥皂水、搅拌 |
9.在某溶液滴入稀盐酸,能产生使澄清石灰水浑浊的气体,这说明某溶液中含有的离子是( )
| A. | Ca2+ | B. | CO32- | C. | SO42- | D. | OH- |