题目内容
(7分)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题:
(1)从试剂瓶中取出10gBaCl2溶液于一个洁净的烧杯中。
(2)用胶头滴管向烧杯中滴加AgNO3溶液,直至 为止,反应的化学方程式为 ;滴加AgNO3溶液时,滴管要保持 ,不要接触器壁, 用毕立即用蒸馏水清洗干净。
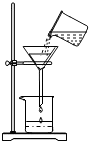
(3)右图所示的过滤装置有两处明显的错误,请用文字叙述加以改正。
; 。

用改正后的装置对(2)中的混合物进行过滤。
(4)把过滤得到的沉淀物移到蒸发皿中加热蒸干,充分干燥后称量,沉淀物的质量是2g,则BaCl2溶液溶质的质量分数为 (精确到0.1%)。
(2)没有白色沉淀产生,BaCl2+ 2AgNO3== 2AgCl↓+ Ba(NO3)2 ;垂直
(3)要用玻璃棒引流;要使漏斗下端管口紧靠烧杯内壁
(4)14.5%(误差超过0.2%者不给分,如14.2%、14.8%等)
【解析】(2)氯化钡和硝酸银反应生成氯化银白色沉淀和硝酸钡,因此直到不再产生白色沉淀时,氯化钡完全反应;滴加AgNO3溶液时,滴管要保持悬空放在烧杯的正上方;故答案为:不再产生白色沉淀;BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2;悬空放在烧杯的正上方;
(3)过滤的过程中,要注意“一贴、二低、三靠”;因此图中的错误改正为:应该用玻璃棒引流;漏斗的下端要紧靠烧杯的内壁;故答案为:应该用玻璃棒引流;漏斗的下端要紧靠烧杯的内壁;
(4)设BaCl2溶液中溶质的质量分数为x
BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
208 287
10g•x 2g
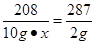 ,解得x≈14.5%
,解得x≈14.5%


(1)同学们想通过测定消耗碳、氧元素的质量和生成二氧化碳的质量,分析氧化铜和炭粉反应产生的气体除CO2外是否还有其它产物.反应一段时间后停止加热,冷却到室温.反应前、后测得的数据如下:
| 装置 | 反应前 | 反应后 |
| A | 试管的质量38.2 克 氧化铜和炭粉混合物的质量20.0克 |
试管和固体物质的质量56.8 克 |
| B | 反应后瓶内石灰水比反应前增重1.1 克 | |
A.装置中还有一部分CO2未被石灰水溶液吸收
B.氧化铜和炭粉反应产生的气体除CO2外还有CO
C.氧化铜和炭粉没有完全反应
D.该反应不符合质量守恒定律
(2)有同学认为用图示装置C代替上面的装置A,加热前先通一会气体X,停止加热后再通一会该气体,这样可使实验测得的数据更能准确的说明问题.你认为在O2、N2和H2三种气体中,X应选择哪一种气体?
(3)实验中最多能得到铜多少克?(写出计算过程)

 (2012?海珠区一模)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题:
(2012?海珠区一模)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题: