题目内容
20.下列提纯方法中,可用来分离KClO3制O2反应后MnO2和KCl的是( )| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 重结晶 |
分析 根据氯化钾易溶于水,二氧化锰难溶于水,进行分析解答.
解答 解:氯化钾易溶于水,二氧化锰难溶于水,可用过滤的方法进行分离.
故选:A.
点评 本题难度不大.掌握常见混合物分离的原理与方法是正确解答本题的关键.

练习册系列答案
相关题目
11.为除去下列物质中的杂质(括号内为杂质),下列操作方法能达到目的是( )
| 选项 | 物质(杂质) | 操作方法 |
| A | CO2(H2O) | 将气体通过盛有火碱的干燥管 |
| B | Cu(CuO) | 通入足量氧气并加热 |
| C | FeCl2(CuCl2) | 加入足量铁屑,充分反应后过滤 |
| D | Na2SO4(Na2CO3) | 加盐酸至恰好不再产生气泡为止 |
| A. | A | B. | B | C. | C | D. | D |
15.实验室可利用碱式碳酸铜[化学式:Cu2(OH)2CO3]制备氧化铜,并进行碳粉还原氧化铜的实验.(已知C中装有白色粉末状无水硫酸铜,遇水能变成蓝色固体CuSO4•5H2O)
①制备氧化铜并检验产物,装置如图1所示(省略夹持仪器):

步骤一:连接A和B,打开活塞,通入空气.
步骤二:关闭活塞,连上C和D,开始加热.
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热.
B中发生反应的化学方程式为::□Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$□CuO+□H2O+□CO2↑
(1)请在□中填入配平后的系数.1211
(2)A的作用是吸收空气中的吸收空气中的二氧化碳和水蒸气
(3)选择t3时停止加热的理由是固体质量不再减少,证明碱式碳酸铜已经完全分解
(4)根据上表数据可计算出玻璃管中原Cu2(OH)2CO3的质量为6.63g.
②一定量碳粉还原①中制得的氧化铜并检验产物是否有CO2生成,装置如图2所示:
(5)实验过程中,观察到F中溶液变浑浊,反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是F中的液体通过导管流入E中,造成试管炸裂
(6)分析:若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因.③不能确定炭粉还原氧化铜的生成物中是否含有二氧化碳.因为可能有①中未分解的碱式碳酸铜在实验②中分解,产生二氧化碳气体,干扰对炭粉还原氧化铜反应生成物的判断..
①制备氧化铜并检验产物,装置如图1所示(省略夹持仪器):

步骤一:连接A和B,打开活塞,通入空气.
步骤二:关闭活塞,连上C和D,开始加热.
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热.
| 加热时间(min) | 0 | t1 | t2 | t3 |
| 玻璃管及其中固体质量(g) | 56.66 | 55.20 | 54.80 | 54.80 |
(1)请在□中填入配平后的系数.1211
(2)A的作用是吸收空气中的吸收空气中的二氧化碳和水蒸气
(3)选择t3时停止加热的理由是固体质量不再减少,证明碱式碳酸铜已经完全分解
(4)根据上表数据可计算出玻璃管中原Cu2(OH)2CO3的质量为6.63g.
②一定量碳粉还原①中制得的氧化铜并检验产物是否有CO2生成,装置如图2所示:
(5)实验过程中,观察到F中溶液变浑浊,反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是F中的液体通过导管流入E中,造成试管炸裂
(6)分析:若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因.③不能确定炭粉还原氧化铜的生成物中是否含有二氧化碳.因为可能有①中未分解的碱式碳酸铜在实验②中分解,产生二氧化碳气体,干扰对炭粉还原氧化铜反应生成物的判断..
5.下列各组物质,不属于同素异形体的是( )
| A. | 金刚石与石墨 | B. | SO2与SO3 | C. | 氧气与臭氧 | D. | 红磷与白磷 |
12.以科学原理和事实为依据进行推理是学习化学的一种重要方法,下列推理合理的是( )
| A. | 物质世界是由一百多种元素组成的,因此可以利用周期表中的元素任意组合新物质 | |
| B. | 原子和分子都是构成物质的微粒,因此物质不是由分子构成,就一定是由原子构成 | |
| C. | H2O和H2O2的组成元素相同,所以它们的性质也完全相同 | |
| D. | 某物质充分燃烧生成二氧化碳和水,所以该物质的组成里一定含有碳、氢两种元素 |

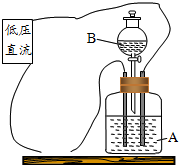 如图是试验物质导电性的装置,瓶中装的一种pH值大于7的溶液A,在连接低压直流电源后,灯泡发光,然后把分液漏斗中的溶液B慢慢注入瓶中,灯泡光亮逐渐变暗,到完全熄灭;继续慢慢注入溶液B,灯泡又逐渐恢复发光.根据上述的变化现象推断:溶液A中的溶质是氢氧化钡,溶液B中的溶质可能是硫酸或硫酸镁.
如图是试验物质导电性的装置,瓶中装的一种pH值大于7的溶液A,在连接低压直流电源后,灯泡发光,然后把分液漏斗中的溶液B慢慢注入瓶中,灯泡光亮逐渐变暗,到完全熄灭;继续慢慢注入溶液B,灯泡又逐渐恢复发光.根据上述的变化现象推断:溶液A中的溶质是氢氧化钡,溶液B中的溶质可能是硫酸或硫酸镁.